গুণগত রসায়ন হল রসায়নের একটি শাখা যা কোনো নির্দিষ্ট পদার্থের মধ্যে কোন উপাদান বা যৌগ উপস্থিত আছে তা নির্ণয় করার সাথে সম্পর্কিত। এটি মূলত একটি পদার্থের গুণগত বৈশিষ্ট্য নির্ণয় করার উপর নির্ভর করে। অর্থাৎ, কোনো পদার্থ কী দিয়ে তৈরি, তা জানার চেষ্টা করা।
গুণগত বিশ্লেষণের জন্য বিভিন্ন পদ্ধতি ব্যবহার করা হয়। এর মধ্যে উল্লেখযোগ্য হল:
গুণগত বিশ্লেষণের বিভিন্ন ক্ষেত্রে ব্যবহার হয়, যেমন:
Fe → Fe2+ → Fe3+
An+ + K4Fe(CN)6] → অধঃক্ষেপ
An+ (aq) + NH4OH(aq) → B (গাঢ় নীল দ্রবণ)।
জন ডাল্টনের পরমাণু মতবাদের পরপরই পরমাণুর গঠন সম্পর্কে বিজ্ঞানীদের মনে কৌতুহল সৃষ্টি হয়। এরই ধারাবাহিকতায় ১৮৯৭-১৯৩২ খ্রিস্টাব্দ পর্যন্ত বিভিন্ন বিজ্ঞানী পরমানুর উপর বিভিন্ন পরীক্ষা - নিরিক্ষার পর প্রাপ্ত তথ্য থেকে পরমাণুর গঠন সম্পর্কে প্রত্যেকেই নিজ নিজ মতবাদ উপস্থাপন করেন যা পরমাণুর মডেল নামে পরিচিত। এদের মধ্যে গুরুত্বপূর্ণ হলো -
(১) থমসন পামপুডিং পরমাণু মডেল : ১৮৯৮ খ্রিস্টাব্দে প্রকাশিত ।
(২) রাদারফোর্ডের পরমাণু মডেল ১৯১১ খ্রিস্টাব্দে প্রকাশিত ।
(৩)বোর পরমাণু মডেল : ১৯১৩ খ্রিস্টাব্দে প্রকাশিত
(৪) বোর - সমারফিল্ড পরমাণু মডেল ১৯১৬ খ্রিস্টাব্দে প্রকাশিত ।
(৫) তরঙ্গ বলবিদ্য পরমাণু মডেল : ১৯২৪ খ্রিস্টাব্দে লুইস দ্য ব্রগলি কর্তক প্রকাশিত
পরমাণুর নিউক্লিয়াস আবিষ্কার :
১৯১১ সালে বিজ্ঞানী আর্নেস্ট রাদারফোর্ডের ছাত্র গিগার এবং ই. মার্সডেন বিখ্যাত a- কণা পরীক্ষা পরিচালনা করেন যা পরমাণুর গঠন সম্পর্কে অত্যান্ত গুরুত্বপূর্ণ তথ্য বহন করে। তারা এই বিশেষ পদ্ধতিতে অতি পাতলা (0.004cm) সোনার পাতে প্রায় (20000) a- কণার প্রবাহ নিক্ষেপ করে দেখেন যে, অধিকাংশ a- কণা পাত ভেদ করে পিছনে রাখা গোলাকার ZnS পর্দকে দীপ্তিমিত করে।
রাদারফোর্ড কর্তৃক a-কণা বিচ্ছুরণ পরীক্ষা :
হিলিয়াম পরমাণু থেকে দুইটি a-কণা বের করে নিলে হিলিয়াম নিউক্লিয়াস বিশিষ্ট থাকে একেই আলফা কণা বলে ।
প্রচন্ড গতিসম্পন্ন a-কণাসমূহকে একটি পাতলা সোনার পাতের উপর নিক্ষেপ করেন। একটি বৃত্তাকার জিংক সালফাইট (ZnS) আবরণযুক্ত একটি পর্দার কেন্দ্রে সোনার পাতটি রাখা হয়
পর্যবেক্ষন :-
১. প্রায় ৯৯% a-কণাই সোনার পাত বেধ করে সোজাসুজি চলে যায় এবং (ZnS) পর্দার উপর প্রতিপ্রভা বা দীপ্তিমান বা আলোকিত করে তোলে ।
২. কিছু সংখ্যাক a-কণা তাদের গতি পথে বেঁকে যায়
৩. প্রায় ২০,০০০ এর মধ্যে ১ টি a-কণা সোজা
বিপরীত দিকে ফিরে আসে।
সিদ্ধান্ত
১. পরমাণুর বেশি ভাগ এলাকাই ফাকা । সেই ফাঁকা স্থানে ইলেকট্রন থাকতে পারে। এদের ভর কম হওয়ায় তারা a-কণার গতিপথের কোন পরিবর্তন ঘটাতে পারে না ৷
২. ভারী কোন কিছুর সাথে সংঘর্ষে লিপ্ত হলেই কিছু সংখ্যক a-কণা বিপরীত দিতে ফিরে আসে । অথাৎ পরমাণুর কেন্দ্রে ভারী বস্তু কণা রয়েছে।
৩. যেহেতু a- কণা ধনাত্মক চার্জ যুক্ত এবং কিছু সংখ্যাক a-কণা বেকে যায় তাই বলা যায় বলা যায় পরমানুর কেন্দ্রে ধনাত্মক চার্জ যুক্ত বস্তু রয়েছে যা দ্বারা a-কণা বিকষিত হয়। ভারী ও ধনাত্মক চার্জ যুক্ত এই কেন্দ্র কে নিউক্লিয়াস বলা হয়। পরমাণুর নিউক্লিয়াসে ধনাত্মক চর্জের পরিমাণ মৌলের পারমানবিক সংখ্যার সমান।
৫. যেহেতু বেশিভাগ - কণান স্বর্ণপাত ভেদ করে বের হয়ে যায় তাই বলা যায় পরমাণুর আকারের তুলনায় নিউক্লিাসের আকার খুবই ছোট। পরমাণুর আকার নিউক্লিাসের থেকে প্রায় ১০ থেকে ১ লক্ষ বড় হতে পারে।
রাদারফোর্ডের পরমাণুর মডেল :
১. পরমানু অত্যন্ত ক্ষুদ্র গোলাকৃতি কণা বিশেষ । এটি দুটি অংশে বিভক্ত ।
(i). কেন্দ্র বা নিউক্লিয়াস
(ii). কেন্দ্র বহির্ভূত অংশ
২. পরমাণুর কেন্দ্রেস্থলে অত্যন্ত ক্ষুদ্র পরিসরে ধনাত্মক চর্জ যুক্ত ভারী কণা বিদ্যমান। একে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলে ।
৩. নিউক্লিয়ার আকার সমগ্র পরমাণুর তুলনায় খুবই ক্ষুদ্র যেখানে পরমাণুর 10 cm ব্যাস নিউক্লিয়াস ব্যাস 10 cm
৪. নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও ভর পুঞ্জিভূত থাকে। তাই মোটামোটি ভাবে নিউক্লিয়াসে ভরই পারমানবিক ভর ।
৫. সাধারন অবস্থায় পরমাণু বিদ্যুৎ নিরেপেক্ষ । কারণ নিউক্লিয়াসে ধনাত্মাক চার্জ যুক্ত প্রোটন সংখ্যা উহার চতুর্দিকে ঘূর্ণয়মান ঋনাত্মক চার্জ যুক্ত ইলেকট্রন সংখ্যা পরষ্পর সমান
৬. সৌরজগতে সূর্যের চারদিকে ঘূর্ণয়মান গ্রহসমূহের মতো পরমাণু নিউক্লিয়াসের চারদিকে কতগুলো ঋণাত্মক কাণিকা সর্বদা ঘূণীয়মান। এগুলোকে ইলেকট্রন বলে ।
৭. সৌরজগতে ন্যায় অথাৎ সূর্যকে কেন্দ্র করে যেভাবে গ্রহগুলো ঘুরে তেমনি ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র সর্বদা ঘূর্ণয়মান। এ ঘূর্ণনের ফলে কেন্দ্রমূখী বল এবং কেন্দ্রবিমূখী বল পরষ্পর সমান থাকে বলে ইলেকট্রনগুলো নিউক্লিয়াসে পতিত হয় না।
রাদারফোর্ডের পরমাণুর মডেলের সীমাবদ্ধতা :
১. সৌরমন্ডলের গ্রহগুলো সামগ্রিকভাবে তড়িৎ নিরপেক্ষ, অথচ ইলেকট্রন ঋণাত্মক চার্জ যুক্ত ।
২. ম্যাক্সওয়েলের তত্ত্ব মতে কোন চার্জযুক্ত কণা অপর কোন চার্জযুক্ত কণাকে কেন্দ্র করে বৃত্তকার পথে ঘুরলে তা অনবরতভাবে শক্তি বিকিরন করবে এবং শক্তি হ্রাস পাওয়ার সাথে সাথে তার আবর্তনশীল বৃত্তাকার পথটি ধীরে ধীরে সংকুচিত হতে থাকবে। ফলে ঋনাত্মক চার্জ যুক্ত ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে গমন করবে।এ অবস্থায় পরমাণুর অস্তিস্ব ধ্বংস হবে। অথচ পরমাণু হতে অনবরত শক্তি বিকিরণ বা ইলেকট্রনেসমূহের নিউক্লিয়াসে পতন কোনটি ঘটবে না ।
৩. ঘূর্ণনরত ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোন কোন ধারনা রাদারফোর্ডেও মডেল থেকে পাওয়া যায় না ।
৪. ঘূর্ণনরত ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোন কোন ধারনা রাদারফোর্ডেও মডেল থেকে পাওয়া যায় না ৷
৫. একাধিক ইলেকট্রন বিশিষ্ট পরমাণুর গঠন এ মডেল ব্যাখ্যা করতে পারে না।
৬. হাইড্রোজেনের বর্ণালীর কোন ব্যাখ্যা এ মডেল থেকে পাওয়া যায় না ৷
বোর পরমাণুর মডেল :
ম্যাক্স প্লাঙ্কের বিকিরন কোয়ান্টাম তত্ত্বের উপর ভিত্তি করে পরমাণুর এবং একই সাথে পারমানবিক বর্ণালী ব্যাখ্যার জন্য নীলস বোর ১৯১৩ সালে তাঁর বিখ্যাত পরমাণু মডেল প্রকাশ করেন। বোর পরমাণুর মডেলের প্রধান তিনটি স্বীকার্য হচ্ছে -
১.ইলেকট্রনের স্থির কক্ষপথ বা শক্তিস্তরের ধারণা:
পরমাণুতে যে সব ইলেকট্রন থাকে তারা নিউক্লিয়ানকে কেন্দ্র করে ইচ্ছমত যে কোন বৃত্তাকার কক্ষপথে বিচরণ করতে পারে না, কেবলমাত্র কতগুলো নির্দিষ্ট ব্যাসার্ধের বৃত্তকার কক্ষপথে কোন রুপ শক্তি বিকিরণ না করে অনবরত ঘুরতে থাকে। এই কক্ষপথগুলোকে শক্তিস্তর বলে। শক্তিস্তর নির্দেশকারী এই সংখ্যাগুলোকে প্রধান কোয়ান্টাম বলে (n)। এই শক্তিস্তরগুলোকে 1,2,3...... ইত্যাদি পূর্ণ সংখ্যা দ্বারা প্রকাশ করা হয়। এই শক্তিস্তরগুলোকে ইংরেজী অক্ষর K,L,M,N... ইত্যাদি দ্বারাও প্রকাশ করা হয়। নিউক্লিয়াস হতে যত দূরে যাওয়া যায় কক্ষপথের শক্তি ততই বৃদ্ধি পায় ।
২.শক্তি শোষণ বা বিকিরণ ও বর্ণালী সৃষ্টির ধারণা :
নির্দিষ্ট বৃত্তাকার কক্ষপথে যেকোন একটিতে বিচরণকালে ইলেকট্রন কোন শক্তি বর্জনও করে না, শোষণও করে না অথাৎ এই কক্ষপথগুলিতে ইলেকট্রন স্থির না থাকলেও এদের শক্তি স্থির থাকে । ইলেকট্রন এক শক্তিস্তর থেকে অন্য শক্তিস্তরে স্থানান্তরিত শক্তির শোষণ বা বিকিরণ ঘটে। উচ্চ শক্তিস্তর (যার শক্তি E2) হতে নিম্ন শক্তিস্ত (যার শক্তি E1) এ স্থানান্তরিত হলে যে শক্তি বিকিরণ হয় তার পরিমাণ হবে (E2– E1) । আবার নিম্ন শক্তিস্তর (যার শক্তি E1) হতে উচ্চ শক্তিস্ত (যার শক্তি E2) এ স্থানান্তরিত হলে যে শক্তি বিকিরণ হয় তার পরিমাণ হবে (E2 - E1 ) । অতএব শোষিত বা বিকিরিত শক্তিকে নিম্নের সমীকরনের সাহায্যে প্রকাশ করা হয়।
বোর পরমাণুর মডেলের সীমাবদ্ধতা :
১. এই মডেল যে সকল পরমাণু বা আয়নে একটি মাত্র ইলেকট্রন থাকে (যেমন- H, He, Li2+) তাদের বর্ণালী ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রন বিশিষ্ট পরমাণুসমূহের বর্ণলী ব্যাখ্যা করতে পারে না
২. ইলেকট্রন যখন এক শক্তিস্তর হতে অপর শক্তিস্তরে স্থানান্তরিত হয় তখন বোর পরমাণু মডেল অনুসারে বর্ণালিতে একটি করে রেখা সৃষ্টি হওয়ার কথা, কিন্তু বাস্তবে অধিকতর সূক্ষ্ম যন্ত্র দ্বারা পরীক্ষা করলে দেখা যায়, পারমাণবিক বর্ণলির প্রতিটি রেখা একাধিক সূক্ষ্ম রেখায় বিভক্ত হয়ে পড়ে। বোরের মতবাদ এর কোন ব্যাখ্যা দিতে পারে না। অবশ্য পরবর্তীতে বোর মতবাদের সম্প্রসারন করে বিজ্ঞানী সমারফিল্ড এর ব্যাখ্য প্রদান করে।
৩. বোর মতবাদ হাইজেনবার্গ এর অনিশ্চয়তার নীতি, স্টার্ক ফলাফল, জীম্যান ফলাফল ব্যাখ্যা করতে পারে না ।
রাদারর্ফোডরে মডলেরে উল্লাযোগ্য প্রস্তাবসমূহ :
১. পরমাণুর কেন্দ্রে ধনাত্মক চার্জযুক্ত নিউক্লিয়াস বিদ্যমান ।
২. পরমাণুর নিউক্লিয়াসের চর্তুদিকে ইলকেট্রন নামক ঋনাত্মক কণকিা সর্বদা ঘূর্ণায়মান ।
৩. নিউক্লিয়াসে ধনাত্মক চার্জ যুক্ত প্রোটন সংখ্যা উহার চর্তুদিকে ঘূর্ণয়মান ঋনাত্মক চার্জ যুক্ত ইলকেট্রন সংখ্যা পরষ্পর সমান বলে পরমাণু বিদ্যুৎ নিরপেক্ষ।
৪. পরমাণুর নিউক্লিয়াস ও ইলকেট্রনরে মধ্যে বিরাজিত কেন্দ্রমূখী স্থির বৈদ্যুতিক আকর্ষন বল এবং কেন্দ্রমূিখী বলরে মান পরষ্পর সমান এবং বিপরীতমুখী ।
বোর মডলেরে উল্লেেযাগ্য প্রস্তাবসমূহ :
১. ইলকেট্রনরে স্থির কক্ষ পথ বা শক্তস্তির সম্পর্কতি ধারণা।
২. ইলকেট্রনরে কৌণকি ভরবগে সম্পর্কিত ধারণা।
৩. ইলকেট্রনরে শক্তি শোষণ, বিকিরণ এবং বর্ণলী সৃষ্টির ধারণা
রাদারর্ফোড ও বোর মডলেরে প্রস্তাবসমূহ বিশ্লেষণ করলে নিম্নলিখিতি বিষয়সমূহ পরলিক্ষতি হয়
১. রাদারর্ফোড মডলে পরমাণুর বর্ণালীর সম্পকে কোন ব্যাখ্যা দিতে না পারলেও বোর মডলে পারে।
২. রাদারর্ফোড মডলে থেকে ইলকেট্রনরে কক্ষপথরে আকার ও আকৃতি সম্বন্ধে কোন ধারণা পাওয়া না গেলেও বোর মডলে থেকে পাওয়া যায় ।
৩. পরমানুর শক্তস্তিরসমূহরে মধ্যে ইলকেট্রন স্থানান্তররে জন্যে সৃষ্ট বভিন্নি বকিরিণ সম্পৰ্কতি ধারণা রাদারর্ফোড মডলে থেকে না পাওয়া গেলেও বোর মডলে থেকে পাওয়া যায়
৪.রাদারর্ফোড মডলে থেকে ইলকেট্রনরে কৌনকি ভরবগে সম্বন্ধে কোন ধারণা পাওয়া না গেলেও বোর মডলে থেকে পাওয়া যায় ।
৫.রাদারর্ফোড মডলেরে সাহায্যে কক্ষপথরে ব্যার্সাধ ইলকেট্রনরে গতবিগে, শক্তি ও বর্ণালীতে উৎপন্ন রেখার কম্পাঙ্ক নির্ণয় করা না গেলেও বোর মডলে থেকে নির্ণয় করা যায়।
৬.রাদারর্ফোড মডলে পরমাণুর সুস্থিতি ব্যাখ্যা করতে না পারলেও বোর মডলে পারে।
তাই বোর মডলে সামান্য কিছু সীমাদ্ধতা থাকলেও পরমাণু গঠন সম্পর্কিত সবচেয়ে বেশি ধারণা আমরা বোর মডলে থেকেই পাই। তাই বোর মডলেটি রাদারর্ফোড মডলে থেকে অধিক গ্রহনযোগ্য
পরমাণুর গঠন বোঝার জন্য তরঙ্গ বলবিদ্যা (Quantum Mechanics) একটি গুরুত্বপূর্ণ বিষয়। এটি একটি আধুনিক তত্ত্ব যা কণা এবং তরঙ্গের দ্বৈত প্রকৃতি ব্যাখ্যা করে। ইলেকট্রন কেবল একটি কণা নয়, এটি একটি তরঙ্গ হিসাবেও আচরণ করে।
তরঙ্গ বলবিদ্যার মূল ভিত্তি:

এখানে, h হলো প্ল্যাঙ্ক ধ্রুবক এবং p হলো কণার ভরবেগ।
স্রোডিঞ্জারের তরঙ্গ সমীকরণ পরমাণুর গঠন বোঝার জন্য এক বিপ্লবী মডেল প্রদান করে। এই সমীকরণের মাধ্যমে ইলেকট্রনের সম্ভাব্য অবস্থান চিহ্নিত করা হয়।
স্রোডিঞ্জারের তরঙ্গ সমীকরণ:
এখানে,
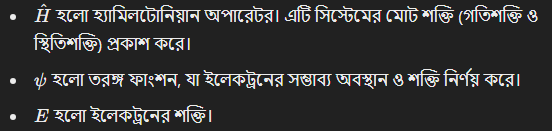

এই মডেল থেকে কক্ষপথ ধারণা (Orbitals) তৈরি হয়েছে, যেখানে ইলেকট্রনগুলি নির্দিষ্ট শক্তির স্তরে থাকে।
পরমাণুর গঠন সম্পর্কে আমাদের ধারণা কীভাবে পরিবর্তিত হয়েছে?
পরমাণুর গঠন সম্পর্কে আমাদের ধারণা কালক্রমে বদলেছে। প্রথমে ডাল্টনের পরমাণু তত্ত্ব, তারপর থমসনের খুদুম খিরা মডেল, রাদারফোর্ডের গ্রহীয় মডেল এবং অবশেষে বোরের মডেল। কিন্তু এই মডেলগুলো পরমাণুর সকল ধর্ম ব্যাখ্যা করতে ব্যর্থ হয়েছে।
কোয়ান্টাম বলবিদ্যা কেন প্রয়োজন?
পরমাণুর সঠিক চিত্র পেতে, বিজ্ঞানীরা কোয়ান্টাম বলবিদ্যার আশ্রয় নিয়েছেন। কোয়ান্টাম বলবিদ্যা পরমাণুর সূক্ষ্ম গঠন এবং তার আচরণ ব্যাখ্যা করতে সক্ষম।
কোয়ান্টাম পরমাণু মডেলের মূল ধারণা:
কোয়ান্টাম পরমাণু মডেলের গুরুত্ব:
কোয়ান্টাম পরমাণু মডেলের সীমাবদ্ধতা:
১। প্রধান কোয়ান্টাম সংখ্যা ,n(Principle quantum number)
যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণুতে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। একে n দ্বারা প্রকাশ করা হয়,n এর মান যথাক্রমে 1,2,3,4,..... প্রভৃতি পূর্ণ সংখ্যা। প্রধান কোয়ান্টাম সংখ্যার মান বৃদ্ধি হলে নিউক্লিয়াস হতে প্রধান স্তরের দূরত্ব এবং শক্তিস্তরের আকার বৃদ্ধি পায়। বোর মতবাদ অনুসারে n=1 হলে ১ম শক্তিস্তর বা K শেল, n=2 হলে ২য় শক্তিস্তর বা L শেল, n=3 এবং n=4 হলে M ও N ইত্যাদি বোঝায়। যে কোনো প্রধান শক্তিস্তর সর্বোচ্চ 2n² ইলেকট্রন ধারণ করতে পারে।
২.সহকারী কোয়ান্টাম সংখ্যা ,ℓ(Azimuthal quantum number)
কৌণিক ভরবেগ কোয়ান্টাম সংখ্যা বা অরবিটাল কোয়ান্টাম সংখ্যা নামেও পরিচিত, সাব শেলকে বর্ণনা করে এবং সম্পর্কের মাধ্যমে অরবিটাল কৌণিক ভরবেগের মাত্রা দেয়।
L2 = ħ2 ℓ (ℓ + 1) রসায়ন এবং বর্ণালীবিদ্যায়, ℓ = 0 কে s অরবিটাল, ℓ = 1, p অরবিটাল, ℓ = 2, d অরবিটাল এবং ℓ = 3, f অরবিটাল বলা হয়।
ℓ এর মান 0 থেকে n −1 পর্যন্ত, তাই প্রথম p অরবিটাল (ℓ = 1) দ্বিতীয় ইলেকট্রন শেলে (n = 2) প্রদর্শিত হয়, প্রথম d অরবিটাল (ℓ = 2) তৃতীয় শেলে (n = 2) প্রদর্শিত হয় = 3), এবং তাই:[2]
ℓ = 0, 1, 2,..., n −1 n = 3, ℓ = 0 থেকে শুরু হওয়া একটি কোয়ান্টাম সংখ্যা, একটি পরমাণুর তৃতীয় ইলেকট্রন শেলের s কক্ষপথে একটি ইলেকট্রনকে বর্ণনা করে। রসায়নে, এই কোয়ান্টাম সংখ্যাটি অত্যন্ত গুরুত্বপূর্ণ, কারণ এটি একটি পারমাণবিক কক্ষপথের আকৃতি নির্দিষ্ট করে এবং রাসায়নিক বন্ধন এবং বন্ধন কোণকে দৃঢ়ভাবে প্রভাবিত করে। আজিমুথাল কোয়ান্টাম সংখ্যাটি একটি কক্ষপথে উপস্থিত কৌণিক নোডের সংখ্যাও নির্দেশ করতে পারে। উদাহরণস্বরূপ, p অরবিটালের জন্য, ℓ = 1 এবং এইভাবে একটি p অরবিটালে কৌণিক নোডের পরিমাণ হল 1।
অরবিটালের আকৃতি আজিমুথাল কোয়ান্টাম সংখ্যা দ্বারা দেওয়া হয়।
৩. চৌম্বকীয় কোয়ান্টাম সংখ্যা ,m(Magnetic quantum number)যে সকল কোয়ান্টাম সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাত্রিক দিক বিন্যাস প্রকরণ সমূহ প্রকাশ করা হয়, তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বা চুম্বকীয় কোয়ান্টাম সংখ্যা বলে। চুম্বকীয় কোয়ান্টাম সংখ্যা, m এর মান


৪. ঘূর্ণন কোয়ান্টাম সংখ্যা ,s(Spin quantum number)
নিজ অক্ষের চারদিকে ইলেকট্রনের ঘুর্ণনের দিক প্রকাশক কোয়ান্টাম সংখ্যা সমূহকে স্পিন কোয়ান্টাম সংখ্যা বা ঘূর্ণন কোয়ান্টাম সংখ্যা বলে। এই কোয়ান্টাম সংখ্যা, s, ফার্মিয়ন কণার বেলায় তা ±½ এর গুণিতক। ইলেক্ট্রনের বেলায় তা ½। +½ ও -½ এর মধ্যে যেকোনো একটিকে ঘড়ির কাটার দিকে ঘূর্ণায়মান ও অপরটি ঘড়ির কাটার বিপরীত অভিমুখে ঘূর্ণায়মান । এটিকে upspin ও downspin electrons ও বলা হয়।
কোয়ান্টাম বলবিদ্যার সাহায্যে পরমাণুর ইলেকট্রনের অবস্থান এবং শক্তিকে আরও স্পষ্টভাবে ব্যাখ্যা করা সম্ভব হয়েছে। এই ব্যাখ্যায় চারটি কোয়ান্টাম সংখ্যা গুরুত্বপূর্ণ ভূমিকা পালন করে। এই চারটি সংখ্যা হল:
প্রধান কোয়ান্টাম সংখ্যা (n):
অজ্ঞাত কোয়ান্টাম সংখ্যা (l):
চৌম্বকীয় কোয়ান্টাম সংখ্যা (m):
স্পিন কোয়ান্টাম সংখ্যা (s):
চারটি কোয়ান্টাম সংখ্যার মূল তাৎপর্য:
পরমাণুরবাদের প্রথমিক ধারণা : -
অজানাকে জানার ইচ্ছা মানব সভ্যতার ক্রমবিকাশের একটি চিরন্তন ধারা। খ্রিস্টপূর্ব ৬৪০ অব্দে বিখ্যাত গ্রিক দার্শনিক লুসিপাস ও ডেমোক্রিটাস সর্বপ্রথম প্রস্তাব করেন, সব পদার্থই অতি ক্ষুদ্র এক ধরনের অবিভাজ্য অসংখ্য কণা দিয়ে তৈরি। প্রায় একই সময়ে ভারতের প্রখ্যাত দার্শনিক কণাদ প্রায় একই ধরনের মতবাদ উপস্থাপন করেন। তিনি প্রস্তাব করেন যে, প্রাকৃতিক সব বস্তুই অসংখ্যা ক্ষুদ্র ক্ষুদ্র পরমাণু নামক অবিভাজ্য কণার সমন্বয়ে গঠিত।
প্রায় ১০০ বছর পর বিখ্যাত গ্রিক দার্শনিক অ্যারিন্টাটল প্রস্তাব করেন, পদার্থ অবিভাজ্য কণার সমষ্টি নয়। সব পার্থিব বস্তুই অবিচ্ছিন্ন পদার্থ দিয়ে গঠিত। অ্যারিস্টাটলের এ মতবাদ প্রায় ২০০০ বছর ব্যাপি প্রচলিত ছিল। পরে আঠার শতকের প্রথম দিকে বিজ্ঞানী স্যার আইজ্যাক নিউটন কর্তৃক পদার্থের গঠন প্রস্তাবিত তত্ত্ব ডেমোক্রিটাসের পরমাণুবাদকে পুনরাই সমর্থন করেন। উনিশ শতকের প্রথম ভাগে ১৮০৩ সালে ব্রিটিশ স্কুল শিক্ষক ও বিজ্ঞানী জন ডাল্টন তার পরমাণুবাদে ডেমোক্রিটাস ও কণাদ এর পরমাণুবাদকে পুনঃপ্রতিষ্ঠা করেন।ডাল্টনের মতবাদ অনুসারে পরমাণু অবিভাজ্য, একে সৃষ্টি বা ধ্বংস করা যায় না । অবশেষে বিংশ শতাব্দীর প্রথমভাগে ১৯১১ সালে বিজ্ঞানী রাদারফোর্ড তার বিখ্যাত আলফা কণা বিচ্ছুরণ পরীক্ষার মাধ্যমে নিশ্চিত রুপে প্রমাণ করেন যে, পরমাণু বিভাজ্য। পরমাণু বিশেষ কতগুলো কণিকার সম্বনয়ে গঠিত। পরমাণুকে বিভাজিত করলে ইলেকট্রন, প্রোটন, ও নিউট্রন প্রভূতি মূল কণিকা পাওয়া যায়। ১৯১৩ সালে বিজ্ঞানী বোর রাদারফোর্ডের পরমাণু মডেলের আরও উৎকর্ষ সাধন করেন
পরমানু ও পরমাণুর মৌলিক কণিকাসমূহ :
মৌলিক পদার্থেও ক্ষুদ্রতম কণা সাধারণত যার স্বাধীন অস্তিত্ব নেই, কিন্তু ক্ষুদ্রতম একক রুপে সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহন করতে পারে, তাকে পরমাণু বলে। প্রত্যেক মৌলের প্রতীক দ্বারা ঐ মৌলের পরমাণুকে বুঝানো হয়। যেমন : H দ্বারা হাইড্রোজেনের পমাণু বুঝায় ।
পরমাণুসমূহকে বিভিন্ন ভাবে ভেঙ্গে যে সব কণা আবিষ্কিত হয়েছে মোটামুটি ভাবে তাদেরকে পরমাণুর মূল কাণিকা বলা হয়। অবশ্য অন্যভাবেও কিছু কিছু কণার সৃষ্টি সম্ভব হয়েছে। তাদের সংখ্যা প্রায় ২০০ এর মত এবং এ সংখ্যা আরও বাড়ছে। মূল উপাদানরূপ যে সব অতি সূক্ষ কণিকা দ্বারা পরমাণু গঠিত তাদের কে পরমাণুর মূল কণিকা বলে
মূল কণিকা দুই প্রকার । যথা :
১. স্থায়ী মূল কণিকা ও
২.অস্থায়ী মূল কণিকা ।
১. স্থায়ী মূল কণিকা : যে সব অতি মূল কণিকা সব মৌলের পরমাণুতে থাকে, তাদেরকে স্থায়ী মূল কণিকা ।
স্থায়ী মূল কণিকা তিন প্রকার যথা :
ক.ইলেকট্রন
খ. প্রোটন
গ.নিউট্রন
২.অস্থায়ী মূল কণিকা : যে সব মূল কণিকা কোন কোন মৌলের পরমাণুতে অতি অল্প সময়ের জন্য অস্থায়ীভাবে থাকে, তাদের কে অস্থায়ী মূল কণিকা বলে। অস্থায়ী কণিকার কয়েকটি হচ্ছে ; (ক) পাইওন (খ) মিউওন (গ) নিউট্রিনো ও (ঘ) মেসন প্রভূতি । অস্থায়ী কণিকাগুলো সৃষ্টির সঙ্গে সঙ্গে অন্য কণায় পরিণত হয়।
স্থায়ী কণিকা :
ক. ইলেকট্রন e : ১৮৯৭ খ্রিস্টাব্দে স্যার জে. জে. থমসন ক্যাথোড রশ্মির উপর পরীক্ষার সময় ইলেকট্রনের অস্থিত্ব আবিষ্কার করেন। সব প্রকার পরমাণুতে কম বেশি ইলেকট্রন বিদ্যমান। পদার্থের মধ্যে ইলেকট্রন সর্বাপেক্ষা ক্ষুদ্রতম কণা ।
ইলেকট্রন আবিষ্কার : তড়িৎ বা চৌম্বকক্ষেত্রে এদের বিক্ষেপনের ধরন থেকে জে. জে. থমসন এই কণাগুলোকে ঋণাত্মক বলে প্রমাণ করেন। এই ঋণাত্মক বিদুৎবাহী কণাগুলো ইলেকট্রন নামে পরিচিত।
লঘু চাপে (0.1 – 0.001 mm (Hg) একটি কাচের আবদ্ধ পাত্রে কোন গ্যাস নিয়ে এর ভিতরে দুটি তড়িৎদ্বার প্রবেশ করিয়ে যতেষ্ঠ বিদ্যুত বিভব প্রয়োগ করলে তড়িৎদ্বার দুইটির ভিতর বিদ্যুৎক্ষরণ হতে থাকে এবং ক্যাথোড হতে সোজাসোজি আলোক রশ্মি বের হয়। কোন বাধা না থাকলে এই রশ্মি ক্যাথোড হতে অ্যানোডের দিকে প্রবাহমান থেকে অ্যানোডের পিছনে কাচের উপর পতিত হয়ে প্রতিপ্রভা সৃষ্টি করে । এরাই ক্যাথোড রশ্মি আবার যদি পাত্রকে কোন তড়িৎ ক্ষেত্রে এমনভাবে বসানো হয় যাতে ক্যাথোড রশ্মির প্রবাহ পথের এক পাশে দ্বিতীয় আরেকটি তড়িৎ ক্ষেত্রের ধনাত্মাক (অ্যানোড) তড়িৎদ্বার ও অপর পাশে ঋনাত্মক তড়িৎদ্বার (ক্যাথোড) থাকে তাহলে দেখা যায় প্রবাহমান এই রশ্মি নিজের পথ থেকে ধনাত্মাক তড়িৎদ্বারের (অ্যানোড) দিকে বেঁকে যায়। এতে বুঝা যায় এই রশ্মি ঋনাত্মক আধানের ক্ষুদ্র প্রবাহ ।
ক্যাথোড রশ্মিতে উৎপন্ন ইলেকট্রনগুলো মুক্ত ও সর্বদাই একই প্রকার। যে কোন গ্যাস থেকে একই ইলেকট্রন রশ্মি বের হয় এবং এরা ক্যাথোডের প্রকৃতির উপর নির্ভরশীল নয় অথাৎ পরীক্ষার সাহয্যে জানা গেছে যে, যে কোন উপায়ে যে কোন উৎস থেকে প্রাপ্ত ও যে কোনো গতিবেগ সম্পন্ন সব ইলেকট্রন একই রকম, একই চার্জ (-1.6×10-19 C) যুক্ত ও একই ভর (9.1085×10-28 g) বিশিষ্ট ।
প্রোটন P : ইলেকট্রনের মত প্রোটনও সব পদর্থের পরমাণুর একটি সাধারন উপাদান । ১৯১৯ খ্রিস্টাব্দে বিজ্ঞানী রাদারফোর্ড এ তথ্য সর্ব প্রথম প্রমাণ করেন । প্রোটন পরমাণুর নিউক্লিয়াসে বিদ্যমান সর্বাপেক্ষ হালকা ধনাত্মক চার্জ বিশিষ্ট একটি স্থায়ী কণা ।
প্রোটন আবিষ্কার : ১৮৮৬ খ্রিস্টাব্দে বিজ্ঞানী গোল্ডস্টাইন ক্যাথোড রশ্মি নল পরীক্ষা দ্বারা ধনাত্মক আয়ন আবিষ্কার করেন। ক্যাথোড রশ্মি যন্ত্রে সচ্ছিদ্র ক্যাথোড ব্যবহার কার হয় তাহলে লক্ষ্য করলে দেখা যায় ক্যাথোড হতে অ্যানোডের দিকে ক্যাথোড রশ্মির মত এক বিপরীত মুখী রশ্মি অ্যানোড হতে ক্যাথোডের দিকে সঞ্চালিত হয়ে ক্যাথোডের ছিদ্র পথে নির্গত হয়ে ক্যাথোড তড়িৎদ্বাড়ের পিছনে কাচের দেওয়ালে দীপ্তিমান (প্রতি প্রভা সৃষ্টির মাধ্যমে) করে তুলে। এ রশ্মিকে অ্যানোড রশ্মি বলে।
আবার যদি পাত্রকে কোন তড়িৎ ক্ষেত্রে এমনভাবে বসানো হয় যাতে অ্যানোড রশ্মির প্রবাহ পথের এক পাশে দ্বিতীয় আরেকটি তড়িৎ ক্ষেত্রের ধনাত্মাক (অ্যানোড) তড়িৎদ্বার ও অপর পাশে ঋনাত্মক তড়িৎদ্বার (ক্যাথোড) থাকে তাহলে দেখা যায় প্রবাহমান এই রশ্মি নিজের পথ থেকে ঋনাত্মক তড়িৎদ্বারের (ক্যাথোড) দিকে বেঁকে যায় । এতে বুঝা যায় এই রশ্মি ধনাত্মক আধানের ক্ষুদ্র প্রবাহ ।
প্রোটনের চার্জ (+1.6×10-19 C) ও ভর (1.672×10-24 g)।
নিউট্রন (n): ১৯২০ খ্রিস্টাব্দে বিজ্ঞানী রাদারফোর্ড পরমাণুর মধ্যে চার্জ বিহীন ও প্রোটনের মত এক একক ভর বিশিষ্ট এক ধরনের মূল কণিকার অস্তিত্ব কল্পনা করেন। কারণ দেখা গেছে, কোন পরমাণুতে উপস্থিত চার্জ যুক্ত প্রোটন এবং ঋনাত্মক চার্জ যুক্ত ইলেকট্রনের মোট ভরের চেয়ে পরমাণুর মোট ভর বা পারমাণবিক ভর বেশি। পরবর্তিতে ১৯৩২ খ্রিস্টাব্দে বিজ্ঞানী জেমস চ্যাডউইক মূল কণিকা হিসাবে পরমাণুর নিউক্লিয়াসে চার্জ নিরপেক্ষ নিউট্রনের উপস্থিতি প্রমাণ করেন ।
পরমাণু সমূহকে তদের প্রোটন, নিউট্রন, এবং ভরের সংখ্যার পাথ্যর্ক বা মিল আমিলের উপর ভিত্তি করে তিনটি ভাগে ভাগ করা যায় যথা :
ক. আইসোটোপ
খ. আইসোবার
গ. আইসোটোন
ক. আইসোটোপ : যে সকল পরমাণুর প্রোটন সংখ্যা অভিন্ন, কিন্তু ভর সংখ্যা ভিন্ন, তাদেরকে পরষ্পরের আইসোটোপ বলে।
আইসোটোপের বৈশিষ্ট :
১. এরা একই মৌলের ভিন্ন ভিন্ন পরমাণু
২. পর্যায় সারণিতে এরা একই ঘরে অবস্থান করে
৩. এদের রাসায়নিক ধর্ম প্রায় একই কিন্তু কতিপয় জৈব ধর্ম ভিন্ন।
৪. এদের প্রোটন সংখ্যা অভিন্ন, কিন্তু ভর সংখ্যা ও
নিউট্রন সংখ্যা ভিন্ন
খ. আইসোবার : যে সব পরমাণুর ভর সংখ্যা অথাৎ নিউক্লিয়াসে প্রোটন ও নিউট্রনের মোট সংখ্যা সমান হয়, কিন্তু প্রোটন সংখ্যা ভিন্ন হয়, তাদের কে আইসোবার বলে ।
আইসোটোনের বৈশিষ্ট :
১. এরা ভিন্ন ভিন্ন মৌলের পরমাণু
২. পর্যায় সারণিতে এরা ভিন্ন ভিন্ন ঘরে অবস্থান করে
৩. এদের ভৌত ও রাসায়নিক ধর্ম ভিন্ন ।
৪. এদের নিউট্রন সংখ্য অভিন্ন, কিন্তু প্রোটন ও ভর সংখ্যা সংখ্যা পরষ্পর ভিন্ন
প্রাথমিক কণিকা : পৃথিবীর প্রতিটি বস্তুই ক্ষুদ্র হতে অতিক্ষুদ্র কণিকা দ্বারা গঠিত এমন ক্ষুদ্র কণিকা রয়েছে যাদের ভর নয় এই কণিকাগুলোকে আমরা প্রাথমিক কণিকা বলতে পারি। সধারনত প্রাথমিক কণিকাগুলোকে তাদের স্পিন বা ঘূর্ণনের উপর ভিত্তি করে দুই ভাগে ভাগ করা হয়। যথা:
(i) ফার্মিয়ন ও
(ii) বোসন
ফার্মিয়ন : ফার্মি-ডিরাক পরিসংখ্যান বলবিদ্যা হতে প্রাপ্ত যে সকল মৌলিক কণিকার স্পিন অর্ধ ইস্টিজার বা পূর্ণসংখ্যা তাদেরকে ফার্মিয়ন বলে ।
বৈশিষ্ট্য :
(i). এরা সকল পদার্থের ক্ষুদ্রতম কণিকা।
(ii). এদের স্পিন অর্ধ পূর্ণ সংখ্যা ।
ফার্মিয়ন প্রধানত দুই প্রকার। যথা
(i). কোয়ার্ক কণিকা
(ii). লেপটন কণিকা
কোয়ার্ক কণিকা : ভগ্নাংশ চার্জ বিশিষ্ট ফার্মিয়ন শ্রেণির কণিকাগুলোকে কোয়ার্ক বলে। যাদের মাধ্যমে হেড্রন তৈরি হয়। কোয়ার্ক কণা ছয় ধরনের।
ক. আপ কোয়ার্ক, এর চার্জ + 2/3
খ. ডাউন কোয়ার্ক, এর চার্জ - 1/3
গ. চার্ম কোয়ার্ক, এর চার্জ + 2/3
ঘ. স্টেঞ্জ কোয়াকর্, এর চার্জ - 1/3
ঙ. টপ কোয়ার্ক, এর চার্জ + 2/3
চ. বটম কোয়ার্ক, এর চার্জ - 1/3
প্রোটন ও নিউট্রন কোয়ার্ক কণা দ্বারা গঠিত। একটি প্রোটন ভাঙ্গা হলে দুইটি আপ কোয়ার্ক একটি ডাউন কোয়ার্ক পাওয়া যায়। এইজন্যই প্রোটনের চার্জ +1 । প্রোটনের চার্জ = (+2/3+ + 2/3) + (- 1/3) = +1 । একটি নিউট্রন ভাঙ্গা হলে একটি আপ কোয়ার্ক দুইটি ডাউন কোয়ার্ক পাওয়া যায়। এইজন্যই প্রোটনের চার্জ + ০। নিউট্রনের চার্জ = (+2/3) + (- 1/3)+(-1/3) = +0|
লেপটন : ফার্মিয়ন শ্রেণির যে সকল কণার মধ্যে শক্তিশালী ইন্টার অ্যাকশন হয় না এবং যাদের চার্জ পূর্ণ সংখ্য আথবা শূন্য তাদের কে লেপটন বলে । লেপটন কণা ছয় প্রকার যথা:
ক. ইলেকট্রন, এর চার্জ, - 1
খ. ইলেকট্রন নিউট্রনো, এর চার্জ, ০
গ. মিউন, এর চার্জ, -1
ঘ. মিউন নিউট্রনো, এর চার্জ, ০
ঙ. টাউ, এর চার্জ, - 1
চ. টাউ নিউট্রনো এর চার্জ, ০
বোসন : বোসন আইনস্টাইনের পরিসংখ্যান বলবিদ্য হতে প্রপ্ত যে সকল যে সকল কণিকার চার্জ পূর্ণসংখ্যা তাদের বোসন বলে। বোসন লেপটন কণা ছয় প্রকার। যথা:
ক. ফোটন, এর চার্জ = 0, স্পিন = 1
খ. W বোনস, এর চার্জ = -1, স্পিন = 1
গ. Z বোসন, এর চার্জ = 0, স্পিন = 1
ঘ. গ্লুওন, এর চার্জ = 0, স্পিন = 1
ঙ. হিগস বোসন, এর চার্জ = 0, স্পিন = 0
চ. গ্রাভিন, এর চার্জ = 0, স্পিন = 2
• পারমাণবিক সংখ্যা বা ভর-ক্রমাঙ্ক (Atomic Number) : কোনো মৌলের পরমাণুর নিউক্লিয়াসে অবস্থিত ধনাত্মক তড়িতের মোট একক সংখ্যাকে ওই মৌলের পারমাণবিক সংখ্যা বা পরমাণু-ক্রমাঙ্ক বলে ।
যেহেতু, প্রত্যেক প্রোটনে ধনাত্মক তড়িতের পরিমাণ এক একক ; সুতরাং, কোনো পরমাণুর নিউক্লিয়াসে অবস্থিত প্রোটনগুলির মোট সংখ্যাই হল ওই পারমাণবিক সংখ্যা । পারমাণবিক সংখ্যাকে 'Z' অক্ষর দ্বারা প্রকাশ করা হয় ।
• ভর সংখ্যা (Mass Number) : কোনো মৌলের একটি পরমাণুর নিউক্লিয়াসের মধ্যে অবস্থিত প্রোটন এবং নিউট্রনের মোট সংখ্যাকে ওই মৌলের বা পরমাণুর ভরসংখ্যা বলে । অর্থাৎ ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা । ভরসংখ্যাকে 'A' অক্ষর দিয়ে প্রকাশ করা হয় ।
• ভর সংখ্যা এবং পারমাণবিক সংখ্যার মধ্যে সম্পর্ক : কোনো মৌলের পরমাণুতে যদি P -সংখ্যক প্রোটন এবং N -সংখ্যক নিউট্রন থাকে, তাহলে
পরমাণুটির ভরসংখ্যা (A) = প্রোটন-সংখ্যা (P) + নিউট্রন-সংখ্যা (N)
যেহেতু, প্রোটন-সংখ্যা (P) = পারমাণবিক-সংখ্যা (Z)
অতএব, ভরসংখ্যা (A) = পারমাণবিক-সংখ্যা (Z) + নিউট্রন-সংখ্যা (N) বা Z = A - N
অক্সিজেনের পারমাণবিক সংখ্যা (Z) = 8 এবং ভর-সংখ্যা (A) = 16 ; সুতরাং অক্সিজেনকে 8O16 লিখে প্রকাশ করা হয় ।
• পারমাণবিক ভর (Atomic mass) : একটি কার্বন-12(6C12) পরমাণুর ভর 12 ধরে অন্য কোনো মৌলের একটি C-12 পরমাণুর ভরের 1/12 অংশ অপেক্ষা যতগুণ ভারী, সেই সংখ্যাকে মৌলটির পারমাণবিক ভর বা পারমাণবিক গুরুত্ব বলে । অর্থাৎ
মৌলের পারমাণবিক ভর = মৌলের 1টি পরমাণুর ভর / 1টি C-12 পরমাণুর ভরের 1/12 অংশ
সমজাতীয় দুটি রাশির অনুপাত হওয়ায় মৌলের পারমাণবিক ভর একটি এককহীন সংখ্যা মাত্র ।
► পারমাণবিক ভর একক (Atomic Mass Unit, সংক্ষেপে amu বা u) :
• সংজ্ঞা:- কোনো মৌলের একটি পরমাণুর প্রকৃত ভরকে যে একক দ্বারা প্রকাশ করা হয়, সেই একককে পারমাণবিক ভর একক বলা হয় ।
এক পারমাণবিক ভর একক (amu বা u) =112×1112×1টি C-12 পরমাণুর প্রকৃত ভর ।
এখান, 1টি কার্বন পরমাণুর ভর =126.023×1023126.023×1023 গ্রাম
সুতরাং, এক পারমাণবিক ভর একক (amu বা u) =112×126.023×1023112×126.023×1023 গ্রাম =1.6603×10−241.6603×10−24গ্রাম =1.6603×10−271.6603×10−27কেজি । এক পারমাণবিক ভর একক (amu বা u) -কে এক ডালটন (Dalton, সংক্ষেপে Da) ও বলা হয় ।
এই এককে প্রোটনের ভর (mp) = 1.0072766 amu বা u
নিউট্রনের ভর (mn) = 1.0086654 amu বা u
ইলেকট্রনের ভর (me) = 0.00055 amu বা u
আইসোটোপ: একই মৌলের এমন সব পরমাণুকে আইসোটোপ বলে, যাদের প্রোটন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা ভিন্ন। অর্থাৎ, আইসোটোপের পারমাণবিক সংখ্যা সমান কিন্তু ভর সংখ্যা ভিন্ন।
আপেক্ষিক পরিমাণ: কোনো মৌলে বিভিন্ন আইসোটোপ থাকলে, প্রকৃতিতে সেই মৌলের বিভিন্ন আইসোটোপের যে পরিমাণে উপস্থিত থাকে, তাকে সেই আইসোটোপের আপেক্ষিক পরিমাণ বলে।
মৌলের পারমাণবিক ভর: কোনো মৌলের একটি পরমাণুর গড় ভরকে মৌলের পারমাণবিক ভর বলে।
পরমাণু সম্পর্কে আলোচনা করার সময়, আমরা প্রায়ই আইসোটোপ, আইসোবার, আইসোটোন ইত্যাদি শব্দ শুনি। এই শব্দগুলো মনে হলে একই ধরনের, কিন্তু আসলে এদের মধ্যে সূক্ষ্ম পার্থক্য রয়েছে। আসুন এই পার্থক্যগুলো বিস্তারিতভাবে জেনে নিই।
সারণি:
| শব্দ | সংজ্ঞা | উদাহরণ |
|---|---|---|
| আইসোটোপ | একই মৌল, ভিন্ন নিউট্রন | H-1, H-2, H-3 |
| আইসোবার | ভিন্ন মৌল, সমান ভর সংখ্যা | C-14, N-14 |
| আইসোটোন | ভিন্ন মৌল, সমান নিউট্রন | C-14, N-15 |
| আইসোমার | একই মৌল, একই ভর সংখ্যা, ভিন্ন নিউক্লিয়ার বিন্যাস | কার্বন-14 এর দুটি আইসোমার |
| আইসোইলেকট্রনিক | ভিন্ন মৌল, সমান ইলেকট্রন | Na+, Mg2+, Al3+, Ne |
| আইসোষ্টার | ভিন্ন মৌল, সমান পরমাণু, সমান ইলেকট্রন, একই ইলেকট্রনিক কনফিগারেশন | CO, N₂ |
একটি পরমাণুকে তিনটি মূল কণিকা দিয়ে গঠিত বলে মনে করা হয়: প্রোটন, নিউট্রন এবং ইলেকট্রন। এই তিনটি কণিকার সংখ্যার উপর নির্ভর করে একটি পরমাণুর ধর্ম এবং তার অবস্থান পর্যায় সারণিতে নির্ধারিত হয়।
উদাহরণ: কার্বন-12 পরমাণুকে ধরা যাক। এর পারমাণবিক সংখ্যা 6 এবং ভর সংখ্যা 12।
পরমাণু সম্পর্কে আলোচনা করার সময় আমরা প্রায়ই আইসোটোপ, আইসোবার এবং আইসোটোন শব্দগুলো শুনি। এগুলো মনে হলে একই ধরনের, কিন্তু আসলে এদের মধ্যে সূক্ষ্ম পার্থক্য রয়েছে। আসুন এই পার্থক্যগুলো বিস্তারিতভাবে জেনে নিই।
সারণি:
| শব্দ | সংজ্ঞা | উদাহরণ |
|---|---|---|
| আইসোটোপ | একই মৌল, ভিন্ন নিউট্রন | H-1, H-2, H-3 |
| আইসোবার | ভিন্ন মৌল, সমান ভর সংখ্যা | C-14, N-14 |
| আইসোটোন | ভিন্ন মৌল, সমান নিউট্রন | C-14, N-15 |
কিছু মৌলের নিউক্লিয়াস অস্থির হয়। এই অস্থির নিউক্লিয়াস স্বতঃস্ফূর্তভাবে কণা বা রশ্মি নির্গত করে স্থিতিশীল অবস্থায় আসার চেষ্টা করে। এই প্রক্রিয়াকেই তেজস্ক্রিয়তা বলে।
একই মৌলের এমন সব পরমাণুকে আইসোটোপ বলা হয়, যাদের প্রোটন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা ভিন্ন। যখন কোনো আইসোটোপের নিউক্লিয়াস অস্থির হয়, তখন তাকে তেজস্ক্রিয় আইসোটোপ বলে।
উদাহরণ: কার্বনের তিনটি আইসোটোপ আছে - কার্বন-12, কার্বন-13 এবং কার্বন-14। এর মধ্যে কার্বন-12 এবং কার্বন-13 স্থিতিশীল, কিন্তু কার্বন-14 তেজস্ক্রিয়।
তেজস্ক্রিয় পদার্থের অর্ধেক পরিমাণ পুরোপুরি ক্ষয় হয়ে যেতে যে সময় লাগে তাকে তেজস্ক্রিয়তার অর্ধায়ু বলে।
পরমাণুর মধ্যে ইলেকট্রন কীভাবে সাজানো থাকে, তা বোঝার জন্য কোয়ান্টাম উপশক্তিস্তর বা অরবিটালের ধারণাটি খুবই গুরুত্বপূর্ণ। এই ধারণাটি আমাদের পরমাণুর গঠন, তার রাসায়নিক বৈশিষ্ট্য এবং পর্যায় সারণিতে তার অবস্থান সম্পর্কে অনেক কিছু জানতে সাহায্য করে।
কোয়ান্টাম উপশক্তিস্তর হল নিউক্লিয়াসের চারপাশে ত্রিমাত্রিক অঞ্চল, যেখানে একটি ইলেকট্রন পাওয়া যাওয়ার সম্ভাবনা সবচেয়ে বেশি। এই উপশক্তিস্তরগুলোর আকার এবং আকৃতি বিভিন্ন ধরনের হতে পারে।
পরমাণুর মধ্যে বিভিন্ন উপশক্তিস্তরের শক্তি ভিন্ন ভিন্ন হয়। এই শক্তিক্রমটি ইলেকট্রন কীভাবে উপশক্তিস্তরগুলোতে সাজানো হবে তা নির্ধারণ করে। সাধারণত, নিম্ন শক্তিস্তরগুলো আগে পূর্ণ হয় এবং তারপর উচ্চ শক্তিস্তরগুলো পূর্ণ হয়।
শক্তিক্রমের একটি সাধারণ নিয়ম হল: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
অরবিটালের আকৃতি বিভিন্ন ধরনের হতে পারে। সাধারণত s, p, d এবং f এই চারটি ধরনের অরবিটাল থাকে।
কোয়ান্টাম সংখ্যা ব্যবহার করে আমরা কোনো একটি ইলেকট্রন কোন উপশক্তিস্তরে অবস্থান করছে তা নির্ণয় করতে পারি। মূলত চারটি কোয়ান্টাম সংখ্যা আছে:
উদাহরণ: কার্বন পরমাণুর ইলেকট্রন বিন্যাস হল 1s² 2s² 2p². এখানে দেখা যাচ্ছে যে, কার্বনের সর্ববহিঃস্থ শক্তিস্তরে 2টি ইলেকট্রন আছে এবং এই ইলেকট্রনগুলো 2p উপশক্তিস্তরে অবস্থান করছে।
শক্তিস্তর বা কক্ষ বা শেল বা অরবিট (Orbit)
বোর পরমাণু মডেলের স্বীকার্য অনুসারে পরমাণু নিউক্লিয়াসের চতুর্দিকে যে নির্দিষ্ট বত্তাকার কক্ষপথে ইলেকট্রন ঘূর্ণায়মান তাকে শক্তিস্তর বা কক্ষ বা অরবিট বলে।
মূলত প্রধান শক্তিস্তরই অরবিট নামে পরিচিত। একে n দ্বারা প্রকাশ করা হয়। n = 1 হলে K শেল বা ১ম অরবিট, n = 2 হলে L শেল বা ২য় অরবিট, n = 3 হলে M শেল বা ৩য় অরবিট, n = 4 হলে N শেল বা ৪র্থ অরবিট।
উপশক্তিস্তর বা উপকক্ষ বা অরবিটাল (Orbital)
পরমাণুস্থ নিউক্লিয়াসের চতুর্দিকে যে নির্দিষ্ট অঞ্চল ব্যাপী ইলেকট্রন প্রাপ্তির সম্ভাবনা সর্বাধিক তাকে উপশক্তিস্তর বা উপকক্ষ বা অরবিটাল বলে। অরবিটাল মূলত ত্রিমাত্রিক অঞ্চল যেখানে ইলেকট্রন মেঘের ঘনত্ব সর্বাধিক (90-95%)।
অরবিটাল বিভিন্ন সহকারী কোয়ান্টাম সংখ্যাকে নির্দেশ করে।
যেমন : সহকারী কোয়ান্টাম সংখ্যা-
1 কে s অরবিটাল দ্বারা প্রকাশ করা হয় ।
2 কে p অরবিটাল দ্বারা প্রকাশ করা হয়।
3 কে d অরবিটাল দ্বারা প্রকাশ করা হয়।
4 কে f অরবিটাল দ্বারা প্রকাশ করা হয়।
বিভিন্ন অরবিটালের আকৃতি বিভিন্ন। যেমন :
s-অরবিটাল গোলাকার অর্থাৎ ত্রিমাত্রিক
p- অরবিটাল ডাম্বেল আকৃতির।
d এবং f অরবিটালের আকৃতি জটিল প্রকৃতির।
প্রকৃতপক্ষে, অরবিটাল হলো তরঙ্গ ফাংশন অর্থাৎ তরঙ্গ বলবিদ্যায় গাণিতিক ফাংশন, যা দ্বারা কোনো পরমাণুতে ইলেকট্রনের অবস্থা বর্ননা করা হয়।
পরমাণুর ইলেকট্রন বিন্যাস
পরমাণুর ইলেকট্রন সংখ্যা একটি স্বতন্ত্র সংখ্যা। যার গঠন দ্বারা পরমাণুর বৈশিষ্ট্য সম্পর্কে ধারণা পাওয়া যায়। কোয়ান্টাম বলবিদ্যার নিয়ম মেনে কোনো পরমাণুর নির্দিষ্ট সংখ্যাক ইলেকট্রন ঐ পরমাণুর বিভিন্ন শক্তি নির্দিষ্ট উপশক্তিস্তরের বিভিন্ন অরবিটালে সজ্জিত থাকে। পরমাণুর বিভিন্ন অরবিটালে ইলেকট্রনের এ সজ্জাকে ইলেকট্রন বিন্যাস বলে। পরমাণুর ইলেকট্রন বিন্যাস কতগুলো সাধারণ নিয়ম মেনে চলে। সেই নিয়মগুলো হলো:-
(ক) পলির বর্জন নীতি (Pauli's Exclusion Principle)
(খ) আউফবাউ নীতি (Aufbau Principle)
(গ) হুন্ডের নীতি (Hund's Rule)
আউফবাউ নীতি (aufbau principle) :
মৌলের পরমাণুতে ইলেক্ট্রন বণ্টনের ক্ষেত্রে কোন শক্তিস্তরের কোন্ অরবিটালে ইলেকট্রন আগে প্রবেশ করে তা যে নিয়ম অনুসারে হয়ে থাকে ঐ নিয়মটিকে বলা হয় আউফবাউ (aufbau) নীতি।
aufbau একটি জার্মান শব্দ। এর অর্থ হল building up বা নিচ থেকে উপরে তৈরির নিয়ম। অর্থাৎ একটি মৌলের পরমাণুতে ইলেকট্রন বিন্যাস গঠনের নিয়মই হচ্ছে Building up principle বা আউফবাউ নিয়ম।
এই নিয়ম অনুসারে মৌলের পরমাণুতে শক্তির উচ্চক্রম অনুসারে অরবিটাল গুলোতে ইলেকট্রন প্রবেশ করে। অর্থাৎ নিম্ন শক্তির অরবিটালে ইলেকট্রন আগে প্রবেশ করবে। এই নিয়ম অনুসারে প্রধান ও সহকারি কোয়ান্টাম সংখ্যার সম্মিলনে (n + 1) অরবিটালের শক্তি নির্ণীত হয়
4p এবং 5s এর মধ্যে কোনটিতে ইলেকট্রন আগে প্রবেশ করবে।
3d এবং 4s এর মধ্যে -
3d এর n = 3, = =2 n=3+2=5
4s এর n = 4 = 0 n= 4+0 =4
যেহেতু 4s এর ক্ষেত্রে n+ এর মান ছোট তাই এই অরবিটালে ইলেকট্রন আগে প্রবেশ করবে।
আইফবাউ নীতি অনুসারে অরবিটালসমূহের শক্তির ক্রম 1s < 2s 2p 3s 3p 4s 3d < < < 4p < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 8s
হুন্ডের নিয়ম(Hund's rule) :
অরবিটালে ইলেকট্রনের চুম্বক শক্তির মান-এর উপর ভিত্তি করে সমশক্তি সম্পন্ন অরবিটালসমূহে ইলেক্ট্রনের বিন্যাস এর নিয়ম হুন্ড কর্তৃক প্রস্তাবিত হয়।
সম শক্তিসম্পন্ন অরবিটালে ইলেকট্রন প্রথমে একটি একটি করে একমুখী স্পিনে প্রবেশ করে, অতঃপর প্রাপ্যতা অনুসারে অবশিষ্ট ইলেকট্রন বিপরীতমুখী স্পিনে প্রবেশ করে।
অর্থাৎ সমশক্তিসম্পন্ন অরবিটালে ইলেকট্রন পারত পক্ষে জোড়ায় জোড়ায় প্রবেশ করে না। কারণ একই মুখী স্পিনের ইলেকট্রনদ্বয় পরস্পরকে বিকর্ষণ করে।
N-পরমাণুর ক্ষেত্রে হুন্ডের নীতি ব্যাখ্যা করা হলো:
N- এর সর্ববহিস্থ P উপস্তরে 3টি ইলেকট্রন বিদ্যমান।
P উপস্তর আবার সমশক্তিসম্পন্ন 2px, 2py, এবং 2pz এই 3টি অরবিটালে বিভক্ত। হুন্ডের নীতি অনুসারে বহিস্তরের ওটি ইলেকট্রন প্রথমে একটি একটি করে একমুখী স্পিনে যথাক্রমে 2px, 2py, এবং 2pz অরবিটালে প্রবেশ করবে।
আবার O পরমাণুর ক্ষেত্রে দেখা যায়, উহার সর্ববহিস্থp-উপাস্তরে 4টি ইলেকট্রন বিদ্যমান । p উপস্তর আবার সমশক্তি সম্পন্ন 2px, 2py, এবং 2pz অরবিটালে বিভক্ত।
হুন্ডের নীতি অনুসারে বহিস্তরের 4টি ইলেকট্রন এর মধ্যে 3টি ইলেকট্রন প্রথমে একটি একটি করে একমুখী স্পিনে যথাক্র 2px, 2py, এবং 2pz অরবিটালে গমন করবে।
পলির বর্জন নীতি
১৯২৫ সালে বিজ্ঞানী ডব্লিউ পলি পরমাণুতে বিভিন্ন শক্তিস্তরে ইলেকট্রনের অবস্থান সম্পর্কে একটি নীতি প্রদান করেন, এটি পলির বর্জন নীতি নামে অভিহিত।
একটি পরমাণুতে দুটি ইলেকট্রনের চারটি কোয়ান্টাম সংখ্যার মান কখনও একইরূপ হতে পারে না। অর্থাৎ একটি পরমাণুতে অবস্থানরত দুটি ইলেকট্রনের চারটি কোয়ান্টাম সংখ্যার মধ্যে সর্বোচ্চ ৩ টির মান একই হলেও ৪র্থ টির মান অবশ্যই ভিন্ন হবে।
যেমন, হিলিয়াম (He) পরমাণুতে 1s অর্বিটালে ২টি ইলেকট্রন থাকে। এই দুটি ইলেকট্রনের 4টি কোয়ান্টাম সংখ্যার মধ্যে প্রথম ওটির মান অনুরূপ হলেও চতুর্থ কোয়ান্টাম সংখ্যা অথাৎ স্পিন কোয়ান্টাম সংখ্যার মান ভিন্ন হয়। যেমন-
১ম ইলেকট্রনের জন্য, n = 1, e = 0 m = 0, s = + 1/2
২য় ইলেকট্রনের জন্য, n = 1, e = 0 m = 0, s = -1/2
উপরের দুটি ইলেকট্রনে চারটি কোয়ান্টাম সংখ্যার মানের সেট থেকে দেখা যাচ্ছে যে, প্রথম তিনটি কোয়ান্টাম সংখ্যার মান অভিন্ন হলেও চতুর্থটি ভিন্ন। কারণ একই অরবিটালে দুই ইলেকট্রনকে থাকতে হলে তাদের পরস্পর বিপরীত স্পিনে আবর্তনশীল থেকে দুই বিপরীত মেরুর চুম্বকের মতো পারস্পরিক আকর্ষণের আওতায় থাকতে হবে। এ কারণে He পরমাণুতে তিনটি কোয়ান্টাম সংখ্যা n, ও m এর মান এক হলেও তার চতুর্থ কোয়ান্টাম সংখ্যা অর্থাৎ স্পিন (s) কোয়ান্টাম সংখ্যার মান ভিন্ন হয় । যা পলির বর্জন নীতিকে প্রমাণ করে ।
প্রধান শক্তিস্তরসমূহে সর্বাধিক ইলেকট্রন সংখ্যা:-
একটি প্রধান শক্তিস্তরের এক বা একাধিক উপশক্তিস্তর এবং উপশক্তিস্তরে এক বা একাধিক অরবিটাল থাকে । প্রধান শক্তিস্তরের মোট ইলেকট্রন বলতে ঐ শক্তিস্তরে বিদ্যমান উপশক্তিস্তরে যে অরবিটাল থাকে তাদের ইলেকট্রনের সমষ্টিকেই বুঝায়। প্রধান শক্তিস্তরের ইলেকট্রন সংখ্যা নির্ণয় করা হয় প্রধান কোয়ান্টাম সংখ্যা (n) এর মানের ভিত্তিতে। পলির বর্জননীতি অনুসারে কোনো পরমাণুর মধ্যে একটি নির্দিষ্ট প্রধান শক্তিস্তরে ইলেকট্রন সংখ্যা নির্ণয় করা হয় প্রধান কোয়ান্টাম সংখ্যা (n) এর মানের ভিত্তিতে। পলির বর্জননীতি অনুসারে কোনো পরমাণুর মধ্যে একটি নির্দিষ্ট প্রধান শক্তিস্তরে সর্বোচ্চ n2 সংখ্যক অরবিটাল সম্ভব। প্রতিটি অরবিটালে বিপরীতে স্পিনের দুটি করে ইলেকট্রন ধারণ করলে সর্বোচ্চ 2x n2 সংখ্যক ইলেকট্রন প্রতিটি প্রধান শক্তিস্তরে থাকতে পারে। যেমন:
১ম শক্তিস্তরে সর্বাধিক ইলেকট্রন থাকতে পারে, 2x n2 = 2x ( 1 ) 2 = 2টি (1s2)।
২য় শক্তিস্তরে সর্বাধিক ইলেকট্রন থাকতে পারে, 2x n2 = 2 x (2) 2 = 8 টি (2s22p6)
৩য় শক্তিস্তরে সর্বাধিক ইলেকট্রন থাকতে পারে, 2x n2 = 2 x (3)2 = 18 টি (3s23p63d10)
এবং ৪র্থ শক্তিস্তরের সর্বাধিক ইলেকট্রন থাকতে পারে, 2x n2 = 2 x (4) 2 = 32 টি (4s24p64d104f14)
ইলেকট্রন বিন্যাসের সাধারণ নিয়মের ব্যতিক্রম:
সাধারণ নিয়মে d4, d, fo, f13 হলে সেটা সত্যিকার ইলেকট্রন বিন্যাস হবে না, এক্ষেত্রে নিকটবর্তী একটি ইলেকট্রন এসে d5, d10, f7, f14 হবেই।
যেমন, Cr(24) → 1s2 2s2 2p6 3s 2 3p 3d 4s2 (সাধারণ নিয়ম অনুযায়ী)
এই ইলেকট্রন বিন্যাস সঠিক সঠিক ইলেকট্রন বিন্যাস - Cr (24) 1s2 2s2 2p63s 2 3p 3d 4s1 -
একই ভাবে, Cu(29) 1s2 2s2 2p6 3s 2 3p 3d - 4s2 (সঠিক নয়)
Cu(29) → 1s2 2s2 2p6 3s 2 3p6 3d 10 4s 1 (সঠিক) -
এই ব্যতিক্রম ইলেকট্রন বিন্যাসের কারণ হিসেবে বলা হয় যে অর্ধপূর্ণ বা সম্পূর্ণভাবে পূর্ণ d এবং f অরবিটালগুলোর স্থায়িত্ব বেশি।s অরবিটাল হতে একটি ইলেকট্রন d বা f অরবিটালে স্থানান্তরিত হয়ে পরমাণুর স্থায়িত্ব বৃদ্ধি করে।
( n + 1 ) নিয়মের ব্যতিক্রম:
ল্যান্থানাম (La) ও অ্যাকটিনিয়াম (Ac) এর ইলেকট্রন বিন্যাসের ক্ষেত্রে (n + 1) নিয়মের ব্যতিক্রম ঘটে। 4f ও 5d উভয় উপকক্ষের ক্ষেত্রে (n+l) এর মান ( 4 + 3 = 7 = 5+ 2) সমান ।
একইভাবে, 5s উভয় উপকক্ষপথের ক্ষেত্রে ( n + 1) এর মান ( 5 + 3 = 8 = 6 + 2 ) সমান। সুতরাং উপকক্ষপথ গুলির শক্তিমাত্রার কম হন 4f < 5d এবং 5f < 6d কাজেই (n + 1) নিয়মানুযায়ী La(57) ও Ac(89) এর ইলেকট্রন বিন্যাস হওয়া উচিত যথাক্রমে [Xe] 4f15d° 6s এবং [Rn] 5f1 6d°7s2। কিন্তু প্রকৃতপক্ষে La ও Ac এর ইলেকট্রন বিন্যাস যথাক্রমে [Xe] 4f° 5d1 6s এবং [Rn] 5f 6d17s2 অর্থাৎ, ল্যান্থানাম ও অ্যাকটিনিয়ামের ক্ষেত্রে ( n + 1) নিয়মের ব্যতিক্রম ঘটে।
বিভিন্ন অরবিটালের আকৃতি
(১)s-অরবিটাল s-অরবিটালের আকৃতি : গোলকের মতো বা বর্তুল আকারের। s অরবিটাল ত্রিমাত্রিকভাবে x অক্ষy অক্ষ z অক্ষ বরাবরে সমভাবে বিস্তৃত থাকে। প্রধান কোয়ান্টাম সংখ্যা n এর মান যত বড় হবে s অরবিটালের আকারও তত বড় হয়।
(২) p-অরবিটাল p-অরবিটালসমূহের আকৃতি : ডাম্বেলের (dumbel) ন্যায়। এদের আকৃতি একই প্রকারের হয় কিন্তু এরা যথাক্রমে x,y,z অক্ষে পরস্পরের উপর লম্বভাবে থাকে। p-অরবিটাল তিনাট S-অরবিটালের মতো নিউক্লিয়াসের চারদিকে সমভাবে বিস্তৃত থাকে না। পরমাণুর কেন্দ্রের দিকে ইলেকট্রন মেঘের ঘনত্ব কম এবং অক্ষ বরাবর ত্রিমাত্রিক স্থানে ইলেকট্রন মেঘের ঘনত্ব সর্বাধিক হয়।
d অরবিটাল : m = +2, + 1, 0, 1, -2 এর জন্য যথাক্রমে dxy, dyz, dzx, dx 2 - y 2, dz2 অরবিটাল পাওয়া যায়। d অরবিটালের আকৃতি চারটি লোববিশিষ্ট দ্বি-ডাম্বেলের মতো। প্রথম তিনটি দুটি অক্ষের মাঝখানে থাকে, যেমন: dxy এর চারটি লোব x ও y উভয় অক্ষের মাঝখানে dxy এর চারটি y এবং z অক্ষের মাঝখানে অবস্থান করে। চতুর্থ অরবিটাল dx2 – y2 এর চারটি লোবব x ও y অক্ষ বরাবর অবস্থান করে। পঞ্চম অরবিটাল dz2 এর মেঘপুঞ্জি চিত্রমতে z অক্ষ বরাবর এবং কিছু মেঘ চক্রাকারে x ও y অক্ষদ্বয়ের ছেদ বিন্দুকে কেন্দ্ৰ করে অবস্থান নেয়।
f অরবিটাল : প্রধান কোয়ান্টাম সংখ্যা n = 4 এবং পরবর্তী থেকে যে কোনো বড় মানের ক্ষেত্রে সহকারী কোয়ান্টাম সংখ্যা, ( = 3) এবং চৌম্বকীয় কোয়ান্টাম সংখ্যা m = - - 3, 2, -1, 0, 1, +2, +3 এর জন্যই ি
অরবিটাল পাওয়া যায়। তাই প্রথম, দ্বিতীয় ও তৃতীয় শক্তিস্তরে কোনো f অর্বিটাল নেই। m = - 3, -2, -1, 0, +1, +2, +3 এর জন্য যথাক্রমে xি(x2-y2), fy(x2 - y2), fz(x2-y2),fz3,fxyzfxz2, fyz2 অরবিটাল পাওয়া যায়।
পরমাণুর ইলেকট্রন বিন্যাস বোঝার জন্য কোয়ান্টাম সংখ্যা এবং অরবিটালের ধারণা জানা জরুরি। একটি পরমাণুর ইলেকট্রন কীভাবে বিভিন্ন শক্তিস্তরে এবং উপশক্তিস্তরে বিন্যাসিত হয়, তা এই বিন্যাস থেকে বোঝা যায়।
ইলেকট্রন বিন্যাসের নিয়ম:
প্রথম ত্রিশটি মৌলের ইলেকট্রন বিন্যাস:
| মৌল | পারমাণবিক সংখ্যা | ইলেকট্রন বিন্যাস |
|---|---|---|
| হাইড্রোজেন (H) | 1 | 1s¹ |
| হিলিয়াম (He) | 2 | 1s² |
| লিথিয়াম (Li) | 3 | 1s² 2s¹ |
| বেরিলিয়াম (Be) | 4 | 1s² 2s² |
| বোরন (B) | 5 | 1s² 2s² 2p¹ |
| কার্বন (C) | 6 | 1s² 2s² 2p² |
| নাইট্রোজেন (N) | 7 | 1s² 2s² 2p³ |
| অক্সিজেন (O) | 8 | 1s² 2s² 2p⁴ |
| ফ্লোরিন (F) | 9 | 1s² 2s² 2p⁵ |
| নিয়ন (Ne) | 10 | 1s² 2s² 2p⁶ |
| সোডিয়াম (Na) | 11 | 1s² 2s² 2p⁶ 3s¹ |
| ম্যাগনেসিয়াম (Mg) | 12 | 1s² 2s² 2p⁶ 3s² |
| অ্যালুমিনিয়াম (Al) | 13 | 1s² 2s² 2p⁶ 3s² 3p¹ |
| সিলিকন (Si) | 14 | 1s² 2s² 2p⁶ 3s² 3p² |
| ফসফরাস (P) | 15 | 1s² 2s² 2p⁶ 3s² 3p³ |
| সালফার (S) | 16 | 1s² 2s² 2p⁶ 3s² 3p⁴ |
| ক্লোরিন (Cl) | 17 | 1s² 2s² 2p⁶ 3s² 3p⁵ |
| আর্গন (Ar) | 18 | 1s² 2s² 2p⁶ 3s² 3p⁶ |
| পটাশিয়াম (K) | 19 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ |
| ক্যালসিয়াম (Ca) | 20 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² |
| স্ক্যান্ডিয়াম (Sc) | 21 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹ |
| টাইটানিয়াম (Ti) | 22 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d² |
| ভ্যানাডিয়াম (V) | 23 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d³ |
| ক্রোমিয়াম (Cr) | 24 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵ |
| ম্যাঙ্গানিজ (Mn) | 25 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ |
| লোহা (Fe) | 26 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶ |
| কোবাল্ট (Co) | 27 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁷ |
| নিকেল (Ni) | 28 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁸ |
| তামা (Cu) | 29 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰ |
| জিংক (Zn) | 30 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ |
তড়িৎ চুম্বকীয় বর্ণালি হল বিভিন্ন তরঙ্গদৈর্ঘ্যের তড়িৎ চুম্বকীয় বিকিরণের সমষ্টি। এই বিকিরণগুলো বিভিন্ন শক্তির হয়ে থাকে এবং বিভিন্ন ধরনের বস্তুর সাথে বিভিন্নভাবে আন্তঃক্রিয়া করে। এই আন্তঃক্রিয়ার ফলে যে বর্ণালি পাওয়া যায়, তাকে তড়িৎ চুম্বকীয় বর্ণালি বলা হয়।
তড়িৎ চুম্বকীয় বর্ণালিকে সাধারণত নিম্নলিখিত অংশে ভাগ করা হয়:
পরমাণুর ইলেকট্রন যখন একটি শক্তিস্তর থেকে অন্য একটি শক্তিস্তরে যায়, তখন এটি শক্তি শোষণ বা নির্গত করে। এই শক্তি তড়িৎ চুম্বকীয় বিকিরণের আকারে নির্গত হয়। বিভিন্ন পরমাণুর ইলেকট্রন বিভিন্ন শক্তিস্তরে থাকার কারণে প্রতিটি পরমাণুর একটি নির্দিষ্ট ধরনের বর্ণালি থাকে। এই বর্ণালিকে পরীক্ষা করে কোনো পদার্থে কোন মৌল আছে তা নির্ণয় করা যায়
তড়িৎ চুম্বকীয় বর্ণালি বিজ্ঞানের বিভিন্ন শাখায়, যেমন পদার্থবিজ্ঞান, রসায়ন, জ্যোতির্বিজ্ঞান ইত্যাদিতে অত্যন্ত গুরুত্বপূর্ণ ভূমিকা পালন করে। এটি আমাদেরকে মহাবিশ্ব সম্পর্কে আরও ভালভাবে বুঝতে সাহায্য করে।
প্ল্যাঙ্কের কোয়ান্টাম তত্ত্ব আধুনিক পদার্থবিজ্ঞানের একটি মূল ভিত্তি। এই তত্ত্বটি আলোকে কণিকা হিসেবে ব্যাখ্যা করে এবং এটিকে আমাদের আশেপাশের বিশ্বকে বোঝার একটি নতুন দৃষ্টিভঙ্গি দিয়েছে।
প্ল্যাঙ্কের মতে, আলো নিরবচ্ছিন্ন তরঙ্গ হিসেবে নয়, বরং ছোট ছোট প্যাকেট বা কোয়ান্টাম আকারে নির্গত হয়। এই কোয়ান্টামগুলোকে ফোটন বলা হয়। ফোটনের শক্তি তার তরঙ্গদৈর্ঘ্যের উপর নির্ভর করে। প্ল্যাঙ্ক এই সম্পর্কটি নিম্নলিখিত সমীকরণ দিয়ে প্রকাশ করেছিলেন:
E = hν
যেখানে,
এই সমীকরণটি বলে যে, একটি ফোটনের শক্তি তার কম্পাঙ্কের সমানুপাতিক।
প্ল্যাঙ্কের কোয়ান্টাম তত্ত্ব আধুনিক পদার্থবিজ্ঞানের একটি মূল ভিত্তি। এই তত্ত্বের আবিষ্কারের পর থেকে, বিজ্ঞানীরা পরমাণু, আলো এবং মহাবিশ্ব সম্পর্কে আমাদের বোঝার ক্ষেত্রে বিপ্লব সাধন করেছেন। কোয়ান্টাম তত্ত্বের উপর ভিত্তি করেই আমরা আজকের দিনে কম্পিউটার, লেজার, এবং অন্যান্য অসংখ্য প্রযুক্তি ব্যবহার করি।
E =hν
E = mc2
λ = hmv
π = cRT
∆
দৃশ্যমান আলো এবং রেখা বর্ণালি, বিশেষ করে পরমাণু ও অণুর গঠন এবং ধর্ম বোঝার ক্ষেত্রে অত্যন্ত গুরুত্বপূর্ণ একটি বিষয়।
লাইম্যান সিরিজ
বামার সিরিজ
প্যাশ্চেন সিরিজ
ব্রাকেট সিরিজ
পাতন হল একটি শুদ্ধিকরণ প্রক্রিয়া যেখানে একটি মিশ্রণ থেকে বিভিন্ন তরল পদার্থকে তাদের উষ্ণতা ভিন্নতার উপর ভিত্তি করে পৃথক করা হয়। এই প্রক্রিয়ায় মিশ্রণকে উত্তপ্ত করা হয়, যার ফলে বাষ্পীভূত হওয়া পদার্থগুলোকে একটি কনডেন্সারের মাধ্যমে তরলে পরিণত করে আলাদা করা হয়।
পাতনের মূলনীতি হল বিভিন্ন তরল পদার্থের বাষ্পচাপের ভিন্নতা। উচ্চ বাষ্পচাপ বিশিষ্ট পদার্থ আগে বাষ্পীভূত হয় এবং কম বাষ্পচাপ বিশিষ্ট পদার্থ পরে বাষ্পীভূত হয়। এই বাষ্পকে ঠান্ডা করে তরলে পরিণত করা হয়, যাকে কনডেনসেট বলা হয়।
লাইম্যান সিরিজ
বামার সিরিজ
প্যাশ্চেন সিরিজ
ব্রাকেট সিরিজ
প্রশ্ন: জাল পাসপোর্ট বা জাল টাকা শনাক্তকরণে UV-রশ্মির ব্যবহার ব্যাখ্যা করো?
আসল টাকার নিরাপত্তা নক্সায় বিদ্যামান ফ্লোরোসেন্ট ফসফোর কালি সূর্যের আলোর অতিবেগুনী রশ্মি যার তরঙ্গ দৈর্ঘ্য 200 375 nm শোষণ করলে তার ইলেকট্রন উচ্চশক্তি স্তরে স্থানান্তরিত হয়। এরপর টাকাটি নড়াচড়া করলে বা আলোর বিপরীতে নিলে উত্তেজিত ইলেকট্রনের কিছু শক্তি তাপ শক্তিতে রূপান্তরিত হয়ে হারিয়ে যায়। অবশিষ্ট শোষিত শক্তি বিকিরণের মাধ্যমে ইলেকট্রন নিম্ন শক্তিস্তরে ফিরে আসে। এক্ষেত্রে অবশিষ্ট যে শক্তির বিকিরণ ঘটে তা দুর্বল হওয়ায় তার তরঙ্গদৈর্ঘ্য বেড়ে দৃশ্যমান অঞ্চলের তরঙ্গ দৈর্ঘ্য 380-780 nm তে পরিণত হয়। তখন উক্ত টাকার ক্ষেত্রে আমরা নির্দিষ্ট বর্ণ দেখতে পাই। যা দেখে টাকাটি জাল না আসল তা বোঝা যায়। কারণ জাল টাকার ক্ষেত্রে ঐ অংশের বর্ণের কোনো পরিবর্তন ঘটে না। অনুরপভাবে পাসপোর্টের ক্ষেত্রেও সুনির্দিষ্ট ফ্লোরোসেন্ট পদার্থ ব্যবহার করে তার নিরাপত্তা বিধান করা হয়।
প্রশ্ন: প্রশ্ন: পরিবৃত্ত তাপমাত্রা কী?
উত্তর: Na2SO4 এর ক্ষেত্রে তাপমাত্রা বৃদ্ধিতে দ্রাব্যতা প্রথমে ধীরে ধীরে বৃদ্ধি পায়। 32°C তাপমাত্রায় এর দ্রাব্যতা সর্বাধিক হয়। 32°C তাপমাত্রার নিম্নে Na2SO4 দ্রবণে Na2SO4. 10 H2O হিসেবে থাকে। কিন্তু 32°C তথা তার অধিক তাপমাত্রায় লবণটি অ্যানহাইড্রেটেড অবস্থায় Na2SO4 এ পরিণত হয় বিধায় তাপমাত্রা বাড়ালে Na2SO4 এর দ্রাব্যতা ধীরে ধীরে হ্রাস পায়। আর্দ্র কেলাস হতে অনার্দ্র কেলাসে পরিণত হওয়ার কারণে দ্রাব্যতার এই ব্যতিক্রম রূপটি দেখা যায়। যে তাপমাত্রায় দ্রাব্যতা লেখচিত্রে এই ব্যতিক্রম দেখা যায় তাকে পরিবৃত্ত তাপমাত্রা বলে। যেমন- Na2SO4 এর ক্ষেত্রে পরিবৃত্ত তাপমাত্রা 32°C ।
প্রশ্ন: প্রতিভা কীভাবে সৃষ্টি হয়? ব্যাখ্যা ।
উত্তর : তড়িৎ চৌম্বকীয় রেডিয়েশনের অতিবেগুনি দৃশ্যমান অঞ্চলের তরঙ্গদৈর্ঘ্য পরিসর হলে 200 - 750 mn। কোন অণুতে এ অঞ্চলের রেডিয়েশন আপতিত হলে অণুর অভ্যন্তরস্থ ইলেকট্রনীয় শক্তিস্তরের পরিবর্তন সাধিত হয়। অণুস্থ বিভিন্ন ইলেকট্রন রেডিয়েশন শোষণ করে উচ্চতর শক্তিস্তরে উপনীত হয়।ইলেকট্রন যখন অস্থিতিশীল উত্তেজিত অবস্থা থেকে সুস্থিত পূর্বাবস্থায় ফিরে আসে,তখন শোষিত শক্তি প্রতিভা হিসেবে বিকিরিত হতে থাকে।
প্রশ্ন:NMR কী?
(What is NMR?)
NMR Nuclear Magnetic Resonance পারমাণবিক চৌম্বকীয় অনুরণন বর্ণালীকপি, যা সাধারণত এনএমআর স্পট্রোস্কোপি বা চৌম্বকীয় অনুরণন বর্ণালী নামে পরিচিত। এটি একটি পারমাণবিক নিউক্লিয়ার চারপাশে স্থানীয় চৌম্বকীয় ক্ষেত্রগুলি পর্যবেক্ষণ করার জন্য একটি বর্ণালী প্রযুক্তি ।
IR এর আওতায় সাধারণভাবে IR রশ্মির তরঙ্গ দৈর্ঘ্য 780nm থেকে 10nm এর আবার বেশ কতগুলো ভাগ আছে।
যেমন:
i. নিকটবর্তী IR [Near IR (NIR)] এর আওতায় : হচ্ছে 780 - 2500nm. চিকিৎসাক্ষেত্রে এর ব্যবহার ঘটে।
ii. মধ্য তরঙ্গ IR [Middle IR (MIR)] এর আওতায় হচ্ছে 2500 5600nm. জৈব যৌগের কার্যকরী মূলক শনাক্ত করলে এটি ব্যবহৃত হয়।
iii. দূরবর্তী IR [Far IRJ এর আওতায় হচ্ছে 5600-10nm. চিকিৎসাক্ষেত্রে এর রশ্মির ব্যাপক ব্যবহার রয়েছে।
এর মধ্যে FIR (Far infrared) এর তরঙ্গ দৈর্ঘ্য বেশি বিধায় শক্তির দিক থেকে এটি দুর্বল। FIR মানুষের ত্বক ভেদ করে শরীরে প্রবেশ করে ধারে ধীরে মানুষের শরীরের তাপমাত্রা বাড়িয়ে দেয়। শরীরের কো ক্ষতি না করে রক্ত চলাচল বৃদ্ধিসহ শরায় কার্যাবলীকে গতিশীল করে দেয়।শরীরে FIR এর মাত্রা বেশি হলে মানুষ সুস্থ থাকে, বিভিন্ন ধরনের রোগ প্রতিরোধ ক্ষমতা বৃদ্ধি পায়। FIR মাত্রা কম হলে মানুষ অসুস্থ বোধ করে। সদ্যপ্রসূত শিশুর মস্তিস্কের ক্ষত নিয়ে। স্ক্যানিং কাজে near-IR রশ্মি ব্যবহার করা হয় ।
১. Near-IR রশ্মি এর ব্যবহার:
Near-IR রশ্মির তরঙ্গ দৈর্ঘ্য 700 - 2500nm অর্থাৎ অপেক্ষাকৃত ছোট। তরঙ্গ দৈর্ঘ্য ছোট হওয়ায় তাপশক্তি তুলনামূলকভাবে বেশি হয়। এজন্য একে মাংশপেশির জমাট বাঁধা, অস্থি থেকে বিচ্ছিন্ন হওয়া ও মাংশপেশির ব্যথা নিরাময়ে ব্যবহৃত হয়। Near - IR রশ্মি প্রয়োগ করে মস্তিষ্কের রক্তের হিমোগ্লোবিনে কি পরিমাণ শোষিত হয়েছে তার পরিমাণ পরিমাপ করে মস্তিষ্কের রোগ নির্ণয় করা হয়। DOT (Diffuse Optical Tomography) পদ্ধতি ব্যবহার করে মাথার খুলির (Cortex) এর কার্যক্রম নির্ণয় করা যায়। সিটি স্ক্যানিং পদ্ধতি মূলত এ পদ্ধতির মূলনীতির উপর প্রতিষ্ঠিত। নবজাতকের মস্তিষ্কের ক্ষত ও গঠন কাঠামোর সঠিক ধারণা পেতে এটি বিশেষ কার্যকর ভূমিকা রাখে। এ রশি অতি সহজেই স্তন্যপায়ী প্রাণীর দেহকোষ কলায় প্রবেশ করতে পারে ও মাংসপেশির ব্যথার নিরাময় ঘটায়।NIR প্রভাবে কোষের অভ্যন্তরে নাইট্রিক অক্সাইড (NO) এর প্রবাহ বেড়ে যায়। NO এর মাধ্যমেই শরীরের স্নায়ু কোষের গুরুত্বপূর্ণ সংকেতগুলো পরিবাহিত হয়। ব্যথা আক্রান্ত কোষে এটি রক্ত সঞ্চালন বাড়িয়ে দেয় ফলে ব্যথা ধীরে ধীরে উপশম হয়। স্নায়ু কোষের ব্যথা অনুভূতি কমিয়ে দেওয়ার ক্ষেত্রে দুটি রাসায়নিক উপাদান প্রধান ভূমিকা রাখে একটি হলো। অ্যাসিটাইলকোলিন (Acetylcholine) ও অপরটি হলো ব্রাডিকিনিন (Bradykinin) | NIR রশ্মির প্রভাবে এ দুটি উপাদান সক্রিয়তা লাভ করে।
২. Middle-IR রশ্মি এর ব্যবহার:
Middle-IR রশ্মির তরঙ্গ দৈর্ঘ্য 2500 5600 nm বিকিরিত আলোর তরঙ্গ দৈর্ঘ্য অপেক্ষাকৃতভাবে বেশি হয়, উৎপাদনের হার ও পরিমাণ near IR থেকে কম হয়। তবে এটি জৈব কার্যকরী মূলক শনাক্তকরণের ক্ষেত্রে বিশেষ ভূমিকা রাখে।
৩. FIR রশ্মি এর ব্যবহার :
রোগ নিরাময়ে FIR রশ্মি বা FIR Therapy এর ভূমিকা:
১. FIR রশ্মি দেহের তাপমাত্রা বৃদ্ধি করে দেহের সূক্ষ্ম নালীকে সম্প্রসারণ করে। এতে রক্তের প্রবাহ, রক্তের মাধ্যমে। দেহের কোমল টিস্যুতে অক্সিজেন সঞ্চালন, রক্ত ও টিস্যুর মধ্যে বিপাক ক্রিয়া বৃদ্ধি করে।
২. FIR রশ্মি দেহের তাপমাত্রা বৃদ্ধি করে বিধায় মেটাবলিজম ক্ষমতা বৃদ্ধি পায়। রক্তের মধ্যে জমে থাকা ক্ষতিকর চর্বি দ্রবীভূত হয়ে যায়, ফলে রক্ত নালীতে বিষাক্ত পদার্থ জমতে দেয় না। এতে লিম্ফোসাইটের গতিশীলতা বেড়ে যায়, রক্তে শ্বেত কণিকার কার্যক্ষমতা বৃদ্ধি পায়, রোগ প্রতিরোধকারী ক্ষমতাকে বৃদ্ধি করে।
৩. FIR রশ্মি ক্যান্সার বা টিউমার আক্রান্ত কোষের বৃদ্ধি প্রতিহত করে।এছাড়া রিউমেটিক আর্থারাইটিস, বাত রোগ, ডায়াবেটিকস, চর্মরোগ, FIR এর সাহায্যে রোগ নির্ণয় শরীরের বিভিন্ন অঙ্গে ব্যথা, মাংশ পেশি শক্ত হয়ে যাওয়া, লিভারের রোগ, আকুপাঙ্কচার, মচকানো ইত্যাদি
রোগে ব্যবহার করা হয়।
৪. নিউমোনিয়া, অ্যাজমা, ব্রঙ্কাইটিস, সাইনোসাইটিস ও শ্বাসনালী প্রবাহের ক্ষেত্রে এবং ভাইরাস, ব্যাকটেরিয়া, ফাঙ্গাস ও প্যারাসাইট জাতীয় রোগ জীবাণু ধ্বংসের ক্ষেত্রে FIR ব্যবহার করা হয়।
৫. মানুষের চামড়ার ভিতরে থাকা থ্যালামেনস্ফোলন অবলোহিত রশ্মি থেকে তাপ নিয়ে, ধমনী ও শিরাকে পাস করে এবং রক্ত সঞ্চালন দ্রুত হয়। যা উচ্চ রক্তচাপজনিত রোগের ঝুঁকি কমায়।
৬. তুকের সৌন্দর্যবর্ধন এবং ত্বকের কোষে এনজাইম কার্যকারিতা বৃদ্ধিতেও অবলোহিত তাপ প্রভাবক হিসেবে কাজ করে।
রোগ নির্ণয়ে MRI পরীক্ষার মূলনীতি
ম্যাগনেটিক রেজোন্যান্স ইমেজিং (এমআরআই)। শরীরের ভেতরের কোনো অঙ্গের স্পষ্ট ছবি পেতে এই পরীক্ষা করা হয়। এর মাধ্যমে সেই অঙ্গের যেকোনো অস্বাভাবিক অবস্থা বা নির্দিষ্ট কোনো রোগ খুব সহজেই নির্ণয় করা যায়।
যেসব রোগনির্ণয়ে এমআরআই
• টিউমার, স্ট্রোকসহ মস্তিষ্কের অন্যান্য রোগ।
• মেরুদণ্ডের রোগ বা আঘাত।
• হাঁটু, গোড়ালি, কবজি, কাঁধ ইত্যাদি অস্থিসন্ধি, হাড় ও মাংসপেশির সমস্যা।
• রক্তনালির রোগ।
• নাক, কান, গলা ও চোখের সমস্যা।
• প্রোস্টেটের সমস্যা।
• ক্যানসার।
• নারীদের তলপেট ও স্তনের অস্বাভাবিকতা।
• লিভার, কিডনি, পিত্তনালিসহ বিভিন্ন আন্ত্রিক রোগ।
এই মেশিনে চৌম্বক ক্ষেত্র তৈরীর জন্য যে চুম্বক ব্যবহার করা হয় তার শক্তি সাধারণত ৫০০০ থেকে ২০০০০ গস (Guass) পর্যন্ত হয়ে থাকে। যেখানে পৃথিবীর চৌম্বক ক্ষেত্রের মান মাত্র ০.৫ গস (Guass)। হাইড্রোজেন পরমাণুর ম্যাগনেটিক মোমেন্ট তথা চৌম্বক ক্ষেত্রের প্রতি সংবেদনশীলতা বেশি (কারণ এতে অযুগ্ম ইলেক্ট্রন থাকে) এবং মানবদেহে এদের সংখ্যা অসীম। তাই হাইড্রোজেনকেই বেছে নেয়া হয়
শিখা পরীক্ষা হল একটি সহজ এবং দ্রুত পদ্ধতি যার মাধ্যমে কোনো দ্রবণে কোন ধাতব আয়ন উপস্থিত আছে তা শনাক্ত করা যায়। এই পদ্ধতিতে বিভিন্ন ধাতুর যৌগকে জ্বালানির শিখায় রাখলে সেই ধাতুর নিজস্ব বর্ণের আলো নির্গত হয়। এই বর্ণের উপর ভিত্তি করে ধাতুটি শনাক্ত করা হয়।
শিখা পরীক্ষার পদ্ধতি:
বিভিন্ন ধাতুর শিখার রং:
শিখা পরীক্ষার সতর্কতা:
শিখা পরীক্ষার সীমাবদ্ধতা:
শিখা পরীক্ষার ব্যবহার:
কোনো নির্দিষ্ট তাপমাত্রায়, নির্দিষ্ট পরিমাণ দ্রাবকে সর্বোচ্চ যে পরিমাণ দ্রব দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ তৈরি করতে পারে, তাকে সেই দ্রবের দ্রাব্যতা বলে।
কোনো স্বল্প দ্রাব্য আয়নিক যৌগের সম্পৃক্ত দ্রবণে উপস্থিত আয়নগুলোর ঘনমাত্রার গুণফলকে দ্রাব্যতা গুণফল বলে। একে Ksp দ্বারা প্রকাশ করা হয়।
উদাহরণ: AgCl এর দ্রাব্যতা গুণফল, Ksp = [Ag+][Cl-] যেখানে, [Ag+] এবং [Cl-] হল যথাক্রমে Ag+ এবং Cl- আয়নগুলোর মোলার ঘনমাত্রা।
দ্রাব্যতা গুণফল ও আয়নিক গুণফল: নির্দিষ্ট তাপমাত্রায় স্বল্প দ্রবণীয় লবণের সম্পৃক্ত দ্রবণের এক মোল দ্রব হতে যে সকল আয়ন পাওয়া যায়, তাদের ঘাত সমন্বিত প্রত্যেকের ঘনমাত্রার গুণফল সর্বদা ধ্রুবক। এ ধ্রুবককে ঐ তাপমাত্রায় লবণটির দ্রাব্যতা গুণফল বলে। অর্থাৎ দ্রাব্যতা গুণফল হলো লবণের সর্বোচ্চ আয়নিক গুণফল। ধরা যাক, কোনো লবণ MpA, জলীয় দ্রবণে নিম্নরূপে আয়নিত হয়- MpAq (aq) = pMq+ (aq) + qAP-(aq)
আয়নিক যৌগের পানিতে দ্রবণীয়তা
Like dissolves like এ নীতিতে বিভিন্ন যৌগ বিভিন্ন দ্রাবকে দ্রবীভূত হয়। এ নীতির অর্থ হলো আয়নিক যৌগ পোলার দ্রাবকে এবং সমযোজী যৌগ অপোলার দ্রাবকে দ্রবীভূত হয়। আয়নিক যৌগ অপোলার (non-polar) দ্রাবকে অদ্রবণীয় হয়। পোলার যৌগ বলতে এমন যৌগকে বোঝায় যার এক প্রান্তে আংশিক ধনাত্মক এবং অন্য প্রান্তে আংশিক ঋণাত্মক আধানের সৃষ্টি হয়, পানি এরূপ একটি পোলার দ্রাবক। তরল NH3, নাইট্রিক এসিড, তরল SO2, তরল HX এসিডসমূহ পোলার দ্রাবক । অপোলার দ্রাবকসমূহের মধ্যে কার্বন টেট্রাক্লোরাইড (CCl4), বেনজিন (C6H6), হেপ্টেন (C7H16), কেরোসিন, ডিজেল প্রভৃতি উল্লেখযোগ্য।
পোলার দ্রাবক পানিতে আয়নিক যৌগ যেমন: NaCl বা গ্রুপ-1 এর ধাতুর হ্যালাইডসমূহ কীভাবে দ্রবীভূত হয়
পোলার দ্রাবকের যেমন: পানি অণুর দুই প্রান্তে দুটি মেরু থাকে।আয়নিক যৌগের যেমন: NaCl এর ঘনকাকৃতির কেলাসকে দ্রবীভূত করার সময় পানির ঋণাত্মক মেরু NaCl এর ধনাত্মক আয়নের দিকে এবং পানির ধনাত্মক মেরু NaCl এর ঋণাত্মক আয়নের দিকে আবর্তিত হয়। ফলে NaCl এর Nat আয়ন ও CI- আয়নসমূহ পানি অণু দ্বারা আকর্ষিত হয় এবং কেলাস ল্যাটিস থেকে ক্রমশ দ্রবণে চলে আসে। Na+ ও Cl- আয়নসমূহ দ্রবণে পুরোপুরি মুক্ত থাকে না। তারা দ্রাবক পানি অণুর সাথে সংযোজিত থাকে (solvated)। NaCl এর ক্ষেত্রে প্রতিটি Na+ আয়ন ও CI- আয়ন ছয়টি করে H2O এর সাথে সংযোজিত থাকে। সংযোজিত H2O এর সংখ্যা আয়নের আকারের ওপর নির্ভর করে। যেমন: Na+ (H2O)6, CIF(H2O)6, F(H2O)4 ইত্যাদি। জলীয় দ্রবণে আয়নিক যৌগের আয়নসমূহের এরূপে পানি অণু সংযোজিত হওয়ার প্রক্রিয়াকে পানি যোজন বা হাইড্রেশন (Hydration) বলা হয়। পানি-যোজন হলো একটি তাপোৎপাদী প্রক্রিয়া ।
হাইড্রেশন শক্তি (Hydration Energy) : প্রতি মোল পরিমাণ ধনাত্মক ও ঋণাত্মক আয়নের সাথে পানি অণুর সংযোগের সময় নির্গত শক্তিকে হাইড্রেশন শক্তি বলে।এ নির্গত তাপ শক্তির প্রভাবে NaCl এর কেলাস-ল্যাটিস থেকে আয়নগুলো পৃথক হয়ে পানিতে দ্রবীভূত থাকে। হাইড্রেশন শক্তি সবসময় ঋণাত্মক হয়। Na+ আয়ন ও CI- আয়নের হাইড্রেশন শক্তি যথাক্রমে- 406kJ mol-1 এবং - 363kJmol-1 |
Na+ + 6H2O 406kJmol-1 → Nat. 6H2O ΔΗ =
CI- + 6H2O kJ mol-1 CI-.6H2O AH = - 363
সবচেয়ে ছোট ধনাত্মক আয়ন Li+ এর হাইড্রেশন
শক্তি হয় - 520 kJmol-1 এবং সবচেয়ে ছোট ঋণাত্মক আয়ন F- এর হাইড্রেশন শক্তি হয় - 524 kJmol-1 |
দ্রবণীয়তার শর্ত: সাধারণত আয়নিক যৌগের হাইড্রেশন শক্তি যখন এর ল্যাটিস-শক্তি বা কেলাস ল্যাটিস ভাঙার শক্তির চেয়ে বেশি হয়; তখন সহজে ঐ যৌগ পানিতে দ্রবীভূত হয়। যেমন-AgCl, AgBr, Agl, BaSO4, PbSO4 ইত্যাদির হাইড্রেশন শক্তি তাদের ল্যাটিস শক্তির চেয়ে অনেক কম। তাই এসব যৌগ কক্ষ তাপমাত্রায় পানিতে দ্রবণীয়। AgCl পানিতে অদ্রবণীয় কিন্তু AgF পানিতে দ্রবণীয়; এর কারণ ফ্লোরাইড আয়ন (F) এর আকার খুব ছোট হওয়ায় F- আয়নের পানি যোজন খুব ঘনিষ্ঠভাবে ঘটে। তাই F- আয়নের হাইড্রেশন শক্তি CI- আয়নের চেয়ে বেশি হয়। ফলে Ag+ ও F আয়নদ্বয়ের মোট হাইড্রেশন শক্তি তাদের কেলাস ল্যাটিস শক্তির চেয়ে বেশি হয় এবং AgF পানিতে দ্রবীভূত হয়। অপরদিকে AgCl এর হাইড্রেশন শক্তি এর ল্যাটিস শক্তির চেয়ে কম হওয়ায় AgCl পানিতে অদ্রবণীয় থাকে।
আবার PbCl2 ঠাণ্ডা পানিতে অদ্রবণীয়, কিন্তু গরম পানিতে দ্রবণীয়। এর কারণ PbCl2 এর হাইড্রেশন শক্তির চেয়ে ল্যাটিস্ শক্তি সামান্য বেশি। তাপ প্রয়োগ করলে ঐ তাপ শক্তি হাইড্রেশন শক্তির সহযোগীরূপে ল্যাটিস্ শক্তিকে অতিক্রম করে এবং উত্তপ্ত অবস্থায় PbCl2 গরম পানিতে দ্রবীভূত থাকে।তাই PbCl2 এর পানিতে দ্রবণীয়তা প্রক্রিয়া হলো প্রকৃত তাপশোষী। অনুরূপভাবে NaCl এর দ্রবণীয়তা মৃদু তাপশোষী হয়।
কেলাস ল্যাটিস (Crystal Latice) : সব আয়নিক যৌগ কেলাসাকার কঠিন পদার্থ হয়। কক্ষ তাপমাত্রায় কোনো আয়নিক যৌগ তরল বা গ্যাসীয় অবস্থায় থাকে না। কেলাস গঠনকালে সমধর্মী আয়নগুলো পরস্পরকে বিকর্ষণ এবং বিপরীতধর্মী আয়নগুলো পরস্পরকে আকর্ষণ করে স্থির বৈদ্যুতিক আকর্ষণ বল দ্বারা নির্দিষ্ট স্থানে ত্রিমাত্রিকভাবে আবদ্ধ হয়ে পড়ে। উভয় প্রকার আয়নগুলোর কেন্দ্রবিন্দুগুলোকে কাল্পনিক রেখা দ্বারা যুক্ত করলে মৌমাছির মৌচাকের মতো যে জালিকা সৃষ্টি হয়, তাকে কেলাসের জালিকা বা কেলাস ল্যাটিস বলে। কেলাস জালিকা বিভিন্ন জ্যামিতিক আকৃতির হতে পারে।ল্যাটিস শক্তি (Latice Energy) : আয়নিক যৌগের কেলাস গঠনকালে বিপরীত আধানযুক্ত ক্যাটায়ন ও অ্যানায়নগুলো স্থির বৈদ্যুতিক আকর্ষণ বলের দ্বারা আকৃষ্ট হয়ে সম্ভাব্য নিকটে আসে। ফলে এদের মধ্যেকার স্থিতিশক্তির মান অপেক্ষাকৃতভাবে হ্রাস পায়। যে পরিমাণ স্থিতি শক্তি হ্রাস পায়, ঠিক সমপরিমাণ শক্তি ঐ যৌগের কেলাস থেকে নির্গত হয় তাকে ঐ আয়নিক যৌগের কেলাস ল্যাটিস শক্তি বলে। যেমন:
Na+ (g) + Cl+(g) KJmol-1 NaCl (s); AH = -788
NaCl এর ল্যাটিস শক্তি - 788 KJmol-1 এবং == NaCl এর ল্যাটিস ভাঙার শক্তি হবে = + 788 KJmol-1 উল্লেখ্য কেলাসে ল্যাটিস গঠন প্রক্রিয়া হলো তাপপাৎপাদী; তাই ল্যাটিস গঠন শক্তির মান ঋণাত্মক হয়। বিপরীতভাবে কেলাস ল্যাটিস ভাঙ্গার শক্তি হলো তাপশোষী প্রক্রিয়া; তাই এটির মান ধনাত্মক হয়। ল্যাটিস ভাঙ্গা প্রক্রিয়ায় শোষিত তাপ শক্তিকে ল্যাটিস এনথালপি বলে।
সংজ্ঞা : গ্যাসীয় অবস্থায় ক্যাটায়ন ও অ্যানায়ন থেকে এক মোল (mole) পরিমাণ আয়নিক যৌগের কেলাস গঠনকালে যে পরিমাণ শক্তি নির্গত বা মুক্ত হয়, তাকে ঐ আয়নিক যৌগের কেলাস ল্যাটিস শক্তি বলে। ল্যাটিস শক্তি হলো কেলাসের Poential energy। তাই কেলাস গঠনের সময় নির্গত শক্তির পরিমাণ যত বেশি হয়, ঐ আয়নিক কেলাস ততো বেশি সুদৃঢ় হয়।
ল্যাটিস শক্তির নির্ভরশীলতা :
(১) আয়নদ্বয়ের আধান : আয়নিক যৌগের আয়নদ্বয়ের আধান বা চার্জের পরিমাণ বৃদ্ধির সাথে কেলাসে ল্যাটিস শক্তির মানও বৃদ্ধি পায়। তখন আয়নিক বন্ধন শক্তি ও স্থায়িত্ব অধিক হয়।
(২) আয়নদ্বয়ের আকার : ধনাত্মক আয়ন ও ঋণাত্মক আয়নের আকার বৃদ্ধির সাথে ল্যাটিস শক্তির মান হ্রাস পায়। কারণ আয়নদ্বয়ের আকার বড় হলে কেলাস ল্যাটিস গঠনে উভয় আয়নের কেন্দ্রবিন্দুর অবস্থান দূরত্ব (d) বৃদ্ধি পায়। কুলম্বের সূত্র মতে, ল্যাটিস শক্তি, F = k(q1-92)/d2 এক্ষেত্রে ধ্রুবক k এর মান কেলাস গঠনে আয়নদ্বয়ের বিন্যাস
প্রকৃতি নির্ভর করে বিভিন্ন হয়ে থাকে।
উল্লেখ্য crystallography বা, কেলাস গঠনভিত্তিক গণনা হলো জটিল পরীক্ষা নির্ভর এ বিষয়টি (১) X-ray Crystallography, (3) Electron diffraction 3 (৩) Neutron diffran (scattering) পদ্ধতিতে আলোচিত।
তবে ফাজানের নিয়ম মতে ধনাত্মক আয়নের আকর্ষণ দ্বারা ঋণাত্মক আয়নের ইলেকট্রন মেঘের অবস্থানের বিকৃতি বা পোলারায়ন ঘটলে তখন ল্যাটিস শক্তির মান ও স্থায়িত্ব হ্রাস পায়। ফলে যৌগে আয়নিক বৈশিষ্ট্য হ্রাস পায়, এবং বিপরীতভাবে সমযোজী ধর্ম বৃদ্ধি পায়। তখন ল্যাটিস শক্তির প্রভাব বা পোলারায়নের প্রভাব, এ দুয়ের মধ্যে কোনো একটির প্রভাব ঐ যৌগে প্রাধান্য পায়। গ্রুপ-1 এর ধাতুর ক্লোরাইড সমূহ LiCI এর বেলায় পোলারায়ন প্রভাব বেশি পড়ে এব অপর চারটি ধাতুর ক্লোরাইডে ল্যাটিস শক্তির প্রভাব বেশি থাকে। এদের মধ্যে থেকে তা বুঝা যায়।
ফাজানের পোলারায়ন সূত্র মতে সমযোজী বৈশিষ্ট্য ক্রম : LiCI > NaCl > KCI > RbCl > CsCl
গ্রুপ-1 ধাতব ক্লোরাইড লবণগুলোর প্রকৃত গলনাঙ্ক ক্রম : NaCl > KCl > RBCl > CsCl > LiCl
*ফাজানের সূত্র মতে, LiCl এর গলনাঙ্ক হ্রাসের ব্যাখ্যা মিলে; কিন্তু অপর ক্লোরাইড লবণগুলোর বেলায় ফাজানের পোলারায়ন সূত্র মতে ক্রমটি অকার্যকর; কিন্তু ল্যাটিস শক্তি-ক্রম কার্যকর হয়েছে প্রমাণিত হয়।
ল্যাটিস শক্তির ব্যবহার :
(১) কোনো কেলাসের ল্যাটিস শক্তির মান জানা থাকলে তা থেকে কেলাসটি পোলার দ্রাবকে কীরূপ দ্রবীভূত হবে তা জানা যায় ৷
(২) ল্যাটিস শক্তির তুলনায় হাইড্রেশন শক্তি যতো বেশি হবে, আয়নিক যৌগের পানিতে দ্রবণীয়তা ততো বেশি হবে।
(৩) ল্যাটিস শক্তি ও হাইড্রেশন শক্তি উভয়েই ক্যাটায়ন ও অ্যানায়নের চার্জ বা আধানের বৃদ্ধির সাথে বাড়ে এবং তাদের আকার বৃদ্ধির সাথে কমে।
(২) ধাতব হাইড্রক্সাইডসমূহের পানিতে দ্রবণীয়তা ল্যাটিস শক্তি ও হাইড্রেশন শক্তি থেকে ব্যাখ্যা করা যায়। যেমন গ্রুপ-2 এর ১ম ধাতু Be এর ছোট আকারের Be2+ আয়ন দ্বারা OH- আয়নের পোলারায়ন বেশি ঘটে; তাই Be(OH)2 পানিতে অদ্রবণীয়; কিন্তু পরবর্তী ধাতুসমূহের হাইড্রক্সাইড যেমন Mg(OH)2, Ca(OH)2 ইত্যাদি পানিতে দ্রবণীয়। কারণ এদের মধ্যে বড় আকারের Mg2+ ও Ca2+ আয়ন দ্বারা পোলারায়ন কম ঘটে।
এক্ষেত্রে অ্যানায়নের চার্জ ও আকার প্রতি ক্ষেত্রে সমান; কিন্তু ধনাত্মক আয়নের আকার ক্রমান্বয়ে বৃদ্ধি পায়। ফলে এদের ল্যাটিস শক্তি ও হাইড্রেশন শক্তি ক্রমাগত হ্রাস পায়। তবে হাইড্রেশন শক্তি অপেক্ষা ল্যাটিস শক্তি কিছুটা দ্রুততর হ্রাস পায়। তখন Be(OH)2 এর ক্ষেত্রে ল্যাটিস শক্তির পরিমাণ এর হাইড্রেশন শক্তির চেয়ে বেশি থাকে। এ কারণে Be (OH)2 পানিতে অদ্রবণীয়।
কিন্তু Mg2+ আয়ন থেকে পরবর্তী Ca2+, Sr2+, Ba2+ আয়নের আকার বৃদ্ধির সাথে এদের হাইড্রেশন শক্তি ল্যাটিস শক্তির চেয়ে বেশি হয়। ফলে এসব মৌলের হাইড্রক্সাইডের পানিতে দ্রাব্যতা ক্রমাগত বাড়ে। তাই Mg(OH)2, Ca(OH)2 পানিতে দ্রবণীয়। গ্রুপ-2 এর ধাতুর হাইড্রক্সাইডের পানিতে দ্রাব্যতা বৃদ্ধির ক্রম হলো:
Mg(OH) 2 < Ca(OH) 2 < Sr(OH) 2 < Ba(OH) 2
দ্রবণে বিভিন্ন ধরনের ক্যাটায়ন ও অ্যানায়ন শনাক্ত করার জন্য বিভিন্ন ধরনের বিকারক ব্যবহার করা হয়। এই বিকারকগুলোর সঠিক ঘনমাত্রা ও পরিমাণে প্রস্তুতি খুবই গুরুত্বপূর্ণ। কারণ, ভুল প্রস্তুতির কারণে পরীক্ষার ফলাফল ভুল হতে পারে।
বিকারক প্রস্তুতির সাধারণ পদ্ধতি:
দ্রবণে ক্যাটায়ন ও অ্যানায়ন শনাক্তকরণের জন্য ব্যবহৃত সাধারণ বিকারকসমূহ এবং তাদের প্রস্তুতি পদ্ধতি নিম্নরূপ:
এই বিকারকসমূহ সঠিকভাবে তৈরি করে যথাযথ পদ্ধতিতে ব্যবহার করলে দ্রবণের ক্যাটায়ন ও অ্যানায়ন শনাক্ত করা সহজ হয়।
সতর্কতা:
ক্যাটায়ন ও অ্যানায়ন শনাক্তকরণে ব্যবহৃত অন্যান্য বিকারক:
বিশেষ দ্রষ্টব্য:
কেলাশন হল একটি রাসায়নিক প্রক্রিয়া যেখানে একটি কেন্দ্রীয় ধাতব আয়নকে এক বা একাধিক বহুদন্তুক যৌগ দ্বারা ঘিরে রাখা হয়। এই বহুদন্তুক যৌগগুলোকে কেল্যাটিং এজেন্ট বা কেল্যাট বলা হয়। এই প্রক্রিয়ায় একটি স্থিতিশীল চক্রাকার কাঠামো তৈরি হয়, যাকে কেল্যাট বলা হয়।
কেলাটিং এজেন্ট হল এমন যৌগ যারা একাধিক দাতা পরমাণু ধারণ করে। এই দাতা পরমাণুগুলো একটি ধাতব আয়নের সাথে একাধিক সমযোজী বন্ধন গঠন করে। এভাবে একটি চক্রাকার কাঠামো তৈরি হয়।
উদাহরণ: EDTA (Ethylenediaminetetraacetic acid) একটি সাধারণ কেল্যাটিং এজেন্ট। এতে চারটি কার্বক্সিল গ্রুপ এবং দুটি নাইট্রোজেন পরমাণু রয়েছে, যা একটি ধাতব আয়নের সাথে ছয়টি সমযোজী বন্ধন গঠন করতে পারে।
কেলাসন পদ্ধতি (Chelation method) হলো একটি রাসায়নিক প্রক্রিয়া যেখানে একটি কেলেটিং এজেন্ট ব্যবহার করে ধাতব আয়নকে জটিল যৌগে পরিণত করা হয়। এই প্রক্রিয়ায়, কেলেটিং এজেন্ট ধাতব আয়নকে কয়েকটি লিগান্ড দিয়ে ঘিরে ধরে এবং একটি স্থিতিশীল জটিল যৌগ (complex) তৈরি করে।
কেলাসন শব্দটি এসেছে গ্রিক শব্দ "chele" থেকে, যার অর্থ "কাঁকড়ার নখর", কারণ কেলেটিং এজেন্ট ধাতব আয়নকে নখরের মতো আটকে রাখে।
EDTA (Ethylene Diamine Tetra acetic Acid) হল সবচেয়ে সাধারণ কেলেটিং এজেন্ট যা বিভিন্ন ধাতব আয়ন যেমন ক্যালসিয়াম (Ca²⁺), ম্যাগনেসিয়াম (Mg²⁺), এবং আয়রন (Fe³⁺) এর সাথে জটিল যৌগ তৈরি করতে ব্যবহৃত হয়। এটি জল পরিশোধন, খাদ্য প্রক্রিয়াজাতকরণ, এবং ঔষধে ব্যবহৃত হয়।
ডাইমারকাপ্টোল (Dimercaprol) বা BAL (British Anti-Lewisite) হলো এক ধরনের কেলেটিং এজেন্ট, যা আর্সেনিক, পারদ, এবং সীসা বিষক্রিয়া দূর করতে ব্যবহৃত হয়। এটি ধাতব আয়নগুলিকে জটিল যৌগে পরিণত করে শরীর থেকে বের করে দেয়।
ডেসফেরিয়ক্সামিন: এটি এক ধরনের কেলেটিং ওষুধ যা আয়রন ও অ্যালুমিনিয়াম বিষক্রিয়া থেকে মুক্তি পেতে ব্যবহৃত হয়।
পাতন হল একটি শুদ্ধিকরণ প্রক্রিয়া যেখানে একটি মিশ্রণ থেকে বিভিন্ন তরল পদার্থকে তাদের উষ্ণতা ভিন্নতার উপর ভিত্তি করে পৃথক করা হয়। এই প্রক্রিয়ায় মিশ্রণকে উত্তপ্ত করা হয়, যার ফলে বাষ্পীভূত হওয়া পদার্থগুলোকে একটি কনডেন্সারের মাধ্যমে তরলে পরিণত করে আলাদা করা হয়।
পাতনের মূলনীতি হল বিভিন্ন তরল পদার্থের বাষ্পচাপের ভিন্নতা। উচ্চ বাষ্পচাপ বিশিষ্ট পদার্থ আগে বাষ্পীভূত হয় এবং কম বাষ্পচাপ বিশিষ্ট পদার্থ পরে বাষ্পীভূত হয়। এই বাষ্পকে ঠান্ডা করে তরলে পরিণত করা হয়, যাকে কনডেনসেট বলা হয়।
আংশিক পাতন বা ভগ্নাংশ পাতন (Fractional Distillation) একটি উন্নত ধরনের পাতন পদ্ধতি, যেখানে মিশ্রণে থাকা বিভিন্ন তরল পদার্থকে তাদের ফুটনাঙ্কের পার্থক্যের ভিত্তিতে ধাপে ধাপে পৃথক করা হয়। এটি এমন মিশ্রণের ক্ষেত্রে ব্যবহৃত হয় যেখানে উপাদানগুলোর ফুটনাঙ্কের পার্থক্য তুলনামূলকভাবে কম থাকে এবং সাধারণ পাতন পদ্ধতি কার্যকর হয় না।
উত্তপ্তকরণ: মিশ্রণটি একটি ফ্লাস্কে রেখে ধীরে ধীরে উত্তপ্ত করা হয়। মিশ্রণে থাকা বিভিন্ন উপাদান ধাপে ধাপে বাষ্পে পরিণত হয়, তাদের ফুটনাঙ্ক অনুযায়ী।
বাষ্পীকরণ: প্রথমে মিশ্রণের কম ফুটনাঙ্কযুক্ত উপাদানটি বাষ্পে পরিণত হয় এবং একটি ভগ্নাংশীকরণ টাওয়ার (Fractionating Column) দিয়ে উপরে ওঠে। এই টাওয়ারটির ভিতরে অনেকগুলো ট্রে বা প্লেট থাকে যা বাষ্পের বারবার ঘনীভবন এবং বাষ্পীভবনের সুযোগ দেয়।
ফ্র্যাকশনেশন (বিভাজন): ভগ্নাংশীকরণ টাওয়ারে বাষ্পটি ধাপে ধাপে উপরে ওঠার সময় কম তাপমাত্রার বাষ্প নিচে থাকে এবং উচ্চ তাপমাত্রার বাষ্প উপরে ওঠে। এতে ভিন্ন ভিন্ন ফুটনাঙ্কযুক্ত পদার্থগুলোর যথাযথ বিভাজন ঘটে।
কনডেনসেশন (ঘনীভবন): টাওয়ারের শীর্ষে পৌঁছানো বাষ্প একটি কনডেনসারে ঠান্ডা হয়ে তরলে পরিণত হয় এবং তা আলাদা পাত্রে সংগ্রহ করা হয়।
সংগ্রহ: পৃথক হওয়া বিভিন্ন ফ্র্যাকশন (ভগ্নাংশ) ভিন্ন ভিন্ন পাত্রে সংগ্রহ করা হয়।
তেল শোধনাগারে: পেট্রোলিয়াম বা অপরিশোধিত তেলকে বিভিন্ন হাইড্রোকার্বন যেমন পেট্রোল, ডিজেল, কেরোসিন, এবং প্রাকৃতিক গ্যাসে পৃথক করার জন্য আংশিক পাতন ব্যবহৃত হয়। এখানে প্রতিটি হাইড্রোকার্বনের ফুটনাঙ্ক অনুযায়ী পৃথক ফ্র্যাকশন সংগ্রহ করা হয়।
এলকোহল এবং পানির মিশ্রণ: কম পরিমাণ এলকোহল বিশুদ্ধ করার জন্য এই পদ্ধতি ব্যবহার করা হয়, যেখানে পানির ফুটনাঙ্কের সাথে এলকোহলের ফুটনাঙ্কের পার্থক্য কম থাকে।
বায়ুর আলাদা উপাদানে বিভাজন: আংশিক পাতনের মাধ্যমে তরল বায়ু থেকে নাইট্রোজেন, অক্সিজেন, এবং আর্গনের মতো গ্যাসগুলো পৃথক করা হয়।
আংশিক কলামে থাকা থালা বা বল্বগুলো বাষ্পকে বারবার তরলে পরিণত করে এবং আবার বাষ্পীভূত করে। এই প্রক্রিয়ায় বাষ্পের মধ্যে উচ্চ বাষ্পচাপ বিশিষ্ট উপাদানের পরিমাণ বাড়তে থাকে এবং কম বাষ্পচাপ বিশিষ্ট উপাদানের পরিমাণ কমতে থাকে। ফলে কলামের উপরের অংশে উচ্চ বাষ্পচাপ বিশিষ্ট উপাদান এবং নিচের অংশে কম বাষ্পচাপ বিশিষ্ট উপাদান সংগ্রহ করা হয়।
| বৈশিষ্ট্য | সাধারণ পাতন | আংশিক পাতন |
|---|---|---|
| কলাম | ব্যবহার হয় না | আংশিক কলাম ব্যবহার হয় |
| পৃথকীকরণের দক্ষতা | কম | বেশি |
| ব্যবহার | কম জটিল মিশ্রণের জন্য | জটিল মিশ্রণের জন্য |
বাষ্প পাতন হল একটি শিল্প প্রক্রিয়া যেখানে একটি তরল মিশ্রণকে উত্তপ্ত করে বাষ্পে পরিণত করা হয় এবং তারপর এই বাষ্পকে ঠান্ডা করে আবার তরলে পরিণত করা হয়। এই প্রক্রিয়ার মাধ্যমে মিশ্রণের বিভিন্ন উপাদানকে পৃথক করা যায়।
নিম্নচাপ পাতন হল একটি বিশেষ ধরনের পাতন প্রক্রিয়া যেখানে একটি পদার্থকে কম চাপের অবস্থায় বাষ্পীভূত করা হয়। এই পদ্ধতিটি সাধারণত উচ্চ তাপমাত্রায় বাষ্পীভূত হওয়া পদার্থগুলোর জন্য ব্যবহৃত হয়, যাদের সাধারণ চাপে বাষ্পীভূত করলে তাদের বিশ্লেষণ বা শুদ্ধিকরণ কঠিন হয়ে যায়।
উর্ধ্বপাতন হল একটি বিশেষ ধরনের পাতন প্রক্রিয়া যেখানে একটি পদার্থ সরাসরি কঠিন অবস্থা থেকে বাষ্প অবস্থায় পরিণত হয় এবং তারপর আবার সরাসরি কঠিন অবস্থায় পরিণত হয়, তরল অবস্থা দিয়ে যাওয়ার প্রয়োজন ছাড়া। এই প্রক্রিয়াটি সাধারণত কঠিন পদার্থগুলোর জন্য ব্যবহৃত হয় যাদের তরল অবস্থা অস্থিতিশীল বা অজানা।
দ্রাবক নিষ্কাশন হল একটি রাসায়নিক পদ্ধতি যেখানে একটি মিশ্রণ থেকে একটি নির্দিষ্ট উপাদানকে পৃথক করার জন্য দ্রাবক ব্যবহার করা হয়। এই পদ্ধতিতে, দ্রাবকটি মিশ্রণের সাথে মিশে যায় এবং নির্দিষ্ট উপাদানটিকে দ্রবীভূত করে। এরপর এই দ্রবণকে অন্য একটি পাত্রে স্থানান্তর করে দ্রাবককে বাষ্পীভূত করে নির্দিষ্ট উপাদানটিকে পৃথক করা হয়।
দ্রাবক নিষ্কাশনের মূলনীতি হল "সদৃশ দ্রাবক সদৃশ পদার্থকে দ্রবীভূত করে"। অর্থাৎ, একটি পোলার দ্রাবক একটি পোলার পদার্থকে আর একটি অপোলার দ্রাবক একটি অপোলার পদার্থকে দ্রবীভূত করতে পারে।
দ্রাবক নিষ্কাশনের পদ্ধতি:
ক্রোমোটোগ্রাফির অর্থ হল বর্ণচিত্ৰণ । রুশ বিজ্ঞানী সোয়েট উদ্ভিদ থেকে ক্লোরোফিল নামক রঙিন যৌগ পৃথক জন্য এ পদ্ধতি উদ্ভাবন করেন। যে বিশ্লেষণ মূলক পদ্ধতিতে জৈব যৌগের দুই বা ততোধিক উপাদানের কোনো মিশ্রণ অপর একটি সচল মাধ্যমকে উক্ত স্থির মাধ্যমের সংস্পর্শে প্রবাহিত করে মিশ্রণের উপাদানগুলোকে অধিশোষণ মাত্রা কিংবা বন্টন সহগের উপর ভিত্তি করে এদেরকে বিভিন্ন স্তরে পৃথক করার পদ্ধতিকে ক্রোমোটাগ্রাফি বলে। ক্রোমোটাগ্রাফিতে দুটি মাধ্যমে থাকে
১. স্থির মাধ্যম
২. সচল মাধ্যম।
সাধারণত তরল বা গ্যাসীয় পদার্থ সচল মাধ্যম হিসাবে এবং কঠিন পদার্থকে স্থির মাধ্যম হিসাবে ব্যবহার করা হয়। প্রথমে মিশ্রণের উপাদানগুলোকে একটি উপযুক্ত দ্রাবকে দ্রবীভত করা হয় এবং স্থির মাধ্যমের উপর প্রয়োজন মতো যোগ করা হয়। অতঃপর মাধ্যমকে স্থির মাধ্যমের সংস্পর্শে প্রবাহিত করা হয়। স্থির মাধ্যম যদি কঠিন পদার্থ হয় তাহলে অধিশোষণ মাত্রার উপর ভিত্তি উপাদানগুলো বিভিন্ন স্তরে পৃথক হয়ে যায়।
কোনো উপাদান স্থির মাধ্যমের অধিশোষক দ্বারা কতটা অধিশোষিত হবে তা নির্ভর করে উপাদানের গঠন প্রকৃতির উপর। উপাদানটি যত বেশি পোলার হবে এর অধিশোষণ মাত্রাও তত বেশি হবে।
যেমন: −COOH>−OH>−NH2>−CHO>−CO−>=C=C=
যদি স্থির মাধ্যম তরল পদার্থ হয় তখন এর মধ্যে সচল মিশ্রণের উপাদানগুলোর বন্টন সহগের উপর ভিত্তি করে উপাদানগুলো বিভিন্ন স্তরে ভাগ হয়ে যায়।
ক্রোমোটোগ্রাফিকে দুই ভাগে ভাগ করা যায়।
(ক) অধিশোষণ ক্রোমোটাগ্রাফি: (Adsorption chromatography)
১। কলাম ক্রোমোটোগ্রাফি (column chromatography)
২। পাতলাস্তর ক্রোমোটোগ্রাফি (thin layer chromatography)
(খ) বন্টন বা বিভাজন ক্রোমোটোগ্রাফি : (partition chromatography)
১। পেপার ক্রোমোটোগ্রাফি (paper chromatography)
২। গ্যাস ক্রোমোটোগ্রাফি (gas chromatography)
Rf বা Retardation Factor Value
R হলো রক্ষণ বা ধারণ গুণাঙ্ক। সাধারণত TLC এবং পেপার ক্রোমোটোগ্রাফিতে Rf এর মান নির্ণয়ের মাধ্যমে কোনো মিশ্রণের উপাদানগুলোকে শনাক্ত করা হয়। একটি নির্দিষ্ট সময় পর ভিত্তি রেখা থেকে কোনো একটি উপাদান কর্তৃক অতিক্রান্ত দূরত্ব এবং দ্রাবক কর্তৃক অতিক্রান্ত দূরত্বের অনুপাতকে ঐ উপাদানের Rf বলে।
Rf=দ্রাবককর্তৃকঅতিক্রান্তদূরত্ব কোনোউপাদানকর্তৃকঅতিক্রান্তদূরত্ব
১। এটি একটি আনুপাতিক রাশি হওয়ায় এর কোনো একক নেই।
২। Rf এর মান সবসময় 1 থেকে কম হয়।
৩। দ্রাবকের প্রকৃতির উপর Rf এর মান নির্ভরশীল।
A উপাদানের Rf=ca
এবং B উপাদানের Rf=cb
কলাম ক্রোমাটোগ্রাফি হল একটি শক্তিশালী পদ্ধতি যার মাধ্যমে মিশ্রণ থেকে বিভিন্ন উপাদানকে পৃথক করা যায়। বিশেষ করে উদ্ভিদের নির্যাস থেকে বিভিন্ন রঙিন উপাদান, যেমন ক্লোরোফিল, ক্যারোটিনয়েড ইত্যাদি, পৃথক করতে এই পদ্ধতিটি ব্যাপকভাবে ব্যবহৃত হয়।
একটি কলাম ক্রোমাটোগ্রাফিতে একটি লম্বা, সংকীর্ণ কলাম থাকে যা একটি নির্দিষ্ট ধরনের অধিশোষক পদার্থ (যেমন সিলিকা জেল, অ্যালুমিনা) দিয়ে পূর্ণ থাকে। এই অধিশোষক পদার্থের কণাগুলির উপর বিভিন্ন যৌগের আলাদা আলাদা আকর্ষণ শক্তি থাকে।
উদ্ভিদের নির্যাস থেকে রঙিন উপাদান পৃথক করার জন্য সাধারণত স্বাভাবিক কলাম ক্রোমাটোগ্রাফি ব্যবহার করা হয়।
পেপার ক্রোমাটোগ্রাফি
মূলনীতি: পেপার ক্রোমাটোগ্রাফি হল বন্টন বা বিভাজন শ্রেণীর ক্রোমাটোগ্রাফি ।এক্ষেত্রে নিষ্ক্রিয় মাধ্যমে হোয়াট ম্যান ফিল্টার কাগজে শোষিত পানি ‘স্থির মাধ্যম’ রূপে এবং সচল মাধ্যমরূপে জৈব দ্রাবক ব্যবহৃত হয়। হোয়াট ম্যান ফিল্টার কাগজের সেলুলোজ সবসময় অল্প পরিমাণ পানি শোষণ করে রাখে । ফলে হোয়াটম্যান কাগজে স্থাপিত নমুনা মিশ্রনের যৌগসমূহ( জৈব বা অজৈব )এক্ষেত্রে দুটি অমিশ্রণীয় দ্রাবক যেমন স্থির মাধ্যম রুপী পানি ও সচল মাধ্যম রুপী জৈব দ্রাবকে এদের দ্রাব্যতার পার্থক্যের ভিত্তিতে পৃথক পৃথকভাবে বিভাজিত হয়ে পড়ে। তখন পানিতে বেশি দ্রবণীয় দ্রব যৌগটি কম বেগে এবং জৈব দ্রাবকে বেশি দ্রবণীয় দ্রব্ যৌগটি বেশি বেগে গতিশীল দ্রাবকের সাথে প্রবাহিত হয়। দ্রব্য ও দ্রাবকের গতিবেগের আনুপাতিক হার Rf (retention factor) এর মান থেকে উপাদান যৌগকে শনাক্ত করা হয় ৷বিভাজন ক্রোমাটোগ্রাফিতে উপাদান যৌগের সর্বাধিক গাঢত্বের ফ্রন্ট এর দূরত্ব ও সচল মাধ্যম দ্রাবকের ফ্রন্ট এর দূরত্বের অনুপাতের অনুপাতকে যৌগটির Rf মান বলে ৷
পদার্থের গুণগত বিশ্লেষণ হল একটি বিজ্ঞানী বা রসায়নবিদের একটি গুরুত্বপূর্ণ হাতিয়ার। এটি একটি নমুনায় উপস্থিত বিভিন্ন উপাদান বা যৌগগুলির পরিচয় নির্ধারণের প্রক্রিয়া। এই বিশ্লেষণের মাধ্যমে আমরা কোনো পদার্থে কী কী উপাদান রয়েছে এবং সেগুলো কী অনুপাতে রয়েছে তা নির্ণয় করতে পারি।
গুণগত বিশ্লেষণকে মূলত দুই ভাগে ভাগ করা যায়:
গুণগত বিশ্লেষণের জন্য বিভিন্ন পদ্ধতি ব্যবহার করা হয়, যেমন:
Read more